Цель и этапы бактериологического исследования. Методы бактериологического исследования
Бактериологический метод исследования (БЛМИ) – метод, основанный на выделении чистых культур бактерий с помощью культивирования на питательных средах и их идентификации до вида на основании изучения морфологических, культуральных, биохимических, генетических, серологических, биологических, экологических характеристик микроорганизмов.
Бактериологическую диагностику инфекций проводят, используя стандартные диагностические схемы, утвержденные Министерством здравоохранения.
Чистая культура – бактерии одного вида, выращенные на питательной среде, свойства которых находятся в процессе изучения.
Штамм – идентифицированная чистая культура микроорганизмов одного вида, выделенная из определенного источника в определенное время. Штаммы одного вида могут несущественно отличаться биохимическими, генетическими, серологическими, биологическими и др. свойствами, а также местом и временем выделения.
Цели БЛМИ:
1. Постановка этиологического диагноза: выделение чистой культуры микроорганизмов и её идентификация.
2. Определение дополнительных свойств, например, чувствительности микроорганизма к антибиотикам и бактериофагам.
3. Определение количества микроорганизмов (важно в диагностике инфекций, вызываемых УПМ).
4. Типирование микроорганизмов, т. е. определение внутривидовых различий на основании изучения генетических и эпидемиологических (фаговаров и сероваров) маркёров. Это используется в эпидемиологических целях, т. к. позволяет установить общность микроорганизмов, выделяемых от разных больных и из разных объектов внешней среды, в различных стационарах, географических регионах.
БЛМИ включает несколько этапов, различных для аэробов, факультативных анаэробов и облигатных анаэробов.
I. Этапы БЛМИ при выделении чистой культуры аэробов и факультативных анаэробов.
Этап.
А.Забор, транспортировка, хранение, предварительная обработка материала. Иногда до посева проводят селективную обработку материала с учетом свойств выделяемого микроорганизма. Например, перед исследованием мокроты или другого материала на присутствие кислотустойчивых микобактерий туберкулеза, материал обрабатывают растворами кислот или щелочей.
Б. Посев в среду обогащения (при необходимости).Его проводят, если в исследуемом материале содержится малое количество бактерий, например, при выделении гемокультуры. Для этого кровь, взятую на высоте лихорадки в большом объёме (8–10 мл у взрослых, 4–5 мл у детей) засевают в среду в соотношении 1:10 (для преодоления действия бактерицидных факторов крови); посев инкубируют при температуре 37 0 С 18-24 ч.
В. Микроскопия исследуемого материала. Из исследуемого материала готовят мазок, окрашивают его по Граму или другим методом и микроскопируют. Оценивают присутствующую микрофлору, ее количество. В ходе дальнейших исследований должны быть выделены микроорганизмы, присутствовавшие в первичном мазке.
Г. Посев на питательные среды с целью получения изолированных колоний. Производят посев материала петлёй или шпателем методом механического разобщения на чашку с дифференциально-диагностической или селективной средой с целью получения изолированных колоний. После посева чашку переворачивают дном кверху (чтобы избежать размазывания колоний капельками конденсационной жидкости), подписывают и помещают в термостат при температуре 37 0 С на 18-24 ч.
Следует помнить, что при посевах и пересевах микробных культур внимание работающего должно быть обращено на соблюдение правил асептики для предупреждения контаминации питательных сред и предупреждения заражения окружающих и самозаражения!
В случае инфекций, вызываемых условно-патогенными микроорганизмами, где имеет значение количество присутствующих микроорганизмов в патологическом материале, делают количественный посев материала, для чего предварительного готовят ряд 100-кратных разведений материала (обычно 3 разведения) в стерильном изотоническом растворе хлорида натрия в пробирках. После чего по 50 мкл каждого разведения высевают на питательные среды в чашках Петри.
Этап.
А. Изучение морфотипов колоний на средах, их микроскопия. Просматривают чашки и отмечают оптимальную питательную среду, скорость роста, характер роста микроорганизмов. Для изучения выбираютизолированные колонии, расположенные по ходу штриха, ближе к центру. Если вырастает несколько типов колоний – каждый исследуется в отдельности. Оценивают признаки колоний (табл. 7). При необходимости чашки с посевамипросматривают через лупу или с помощью микроскопа с объективом малого увеличения и суженной диафрагмой. Изучают тинкториальные свойства отличающихся морфотипов колоний, для этого из части исследуемой колонии готовят мазок, окрашивают по Граму или другими методами, микроскопируют и определяют морфологию чистоту культуры.При необходимости ставят ориентировочную РА на стекле с поливалентными сыворотками.
Б. Накопление чистой культуры. Для накопления чистой культуры изолированные колонии всех морфотипов пересевают в отдельные пробирки со скошенным агаром или какой-либо другой питательной средой и инкубируют в термостате при +37 0 С (такая температура оптимальна для большинства микроорганизмов, но может быть и другой, например, для Campylobacterium spp. – +42 0 C, Candida spp. и Yersinia pestis – +25 0 C).
В качестве среды накопления для энтеробактерий обычно используют среду Клиглера.
Состав среды Клиглера: МПА, 0,1% глюкозы, 1% лактозы, реактив на сероводород (сернокислое железо + тиосульфат натрия + сульфит натрия), индикатор феноловый красный. Изначальный цвет среды малиново-красный, среда «скошена» в пробирках: имеет столбик (2/3) и скошенную поверхность (1/3).
Посев в среду Клиглера производится штрихом по поверхности и уколом в столбик.
Этап.
А. Учет роста на среде накопления, оценка чистоты культуры в мазке по Граму.Отмечают характер роста выделенной чистой культуры. Визуально чистая культура характеризуется однородным ростом. При микроскопическом исследовании окрашенного мазка, приготовленного из такой культуры, в нём в разных полях зрения обнаруживаются морфологически и тинкториально однородные клетки. Однако в случае выраженного плеоморфизма, присущего некоторым видам бактерий, в мазках из чистой культуры могут встречаться одновременно клетки с различной морфологией.
Если в качестве среды накопления использовали индикаторную среду Клиглера, то оценивают изменения ее цвета в столбике и скошенной части, по которым определяют биохимические свойства: ферментацию глюкозы, лактозы и продукцию сероводорода. При разложении лактозы желтеет скошенная часть среды, при разложении глюкозы – желтеет столбик. При образовании CO 2 в процессе разложения сахаров образуются газовые пузырьки или разрыв столбика. В случае продукции сероводорода отмечается почернение по ходу укола из-за превращении сульфата железа в сульфид железа.
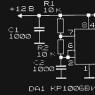
Характер изменения цвета среды Клиглера (рис. 23) объясняется неодинаковой интенсивностью расщепления микроорганизмами азотистых веществ и образования щелочных продуктов в аэробных (на скошенной поверхности) и анаэробных (в столбике) условиях.
В аэробных условиях на скошенной поверхности происходит более интенсивное щелочеобразование, чем в столбике среды. Поэтому при разложении глюкозы, присутствующей в среде в небольшом количестве, образующаяся на скошенной поверхности кислота быстро нейтрализуется. В то же время при разложении лактозы, присутствующей в среде в высокой концентрации, щелочные продукты не способны нейтрализовать кислоту.
В анаэробных условиях в столбике щелочные продукты образуются в ничтожном количестве, поэтому здесь выявляется ферментация глюкозы.
Рис. 23. Индикаторная среда Клиглера:
1 – исходная,
2 – с ростом E. coli,
3– с ростом S. paratyphi B,
4 –с ростом S. typhi
E. coli разлагают глюкозу и лактозу с газообразованием, не продуцируют сероводород. Они вызывают пожелтение столбика и скошенной части с разрывами среды.
S. paratyphi разлагают глюкозу с газообразованием, лактозоотрицательны. Они вызывают пожелтение столбика с разрывами, скошенная часть не изменяет цвет и остается малиновой. При этом S. paratyphi B продуцируют сероводород (по ходу укола появляется черная окраска), S. paratyphi A сероводород не продуцируют.
S. typhi разлагают глюкозу без газообразования, лактозоотрицательны, продуцируют сероводород. Они вызывают пожелтение столбика без разрывов, скошенная часть не изменяет цвет и остается малиновой, по ходу укола появляется черная окраска.
Shigella spp. глюкозопозитивны, лактозоотрицательны, не продуцируют сероводород. Они вызывают пожелтение столбика (с разрывами или без них в зависимости от серовара), скошенная часть не изменяет цвет и остается малиновой.
Б. Окончательная идентификация чистой культуры (определение систематического положения выделенного микроорганизма до уровня вида или варианта) и определение спектра чувствительности выделенной культуры к антибиотикам.
Для идентификации чистой культуры на этом этапе изучают биохимические, генетические, серологические и биологические признаки (табл. 8).
В рутинной лабораторной практике при идентификации нет необходимости изучать все свойства. Используютинформативные, доступные, простые тесты, достаточные для определения видовой (вариантной) принадлежности выделенного микроорганизма.
Культуральный (бактериологический) метод исследования - совокупность способов, направленных на выделение и идентификацию чистых культур микроорганизмов (бактерий) с помощью культивирования на питательных средах.
Чистая культура - совокупность микроорганизмов одного вида. Чаще всего чистую культуру получают путем отбора и культивирования изолированной колонии (потомство одной микробной клетки).
Этапы метода:
1. Забор материала для исследования.
2. Выделение чистой культуры и ее идентификация.
3. Заключение.
Забор материала для исследования. Вид исследуемого материала зависит от цели исследования (диагностика - от больного; эпиданализ - из внешней среды, продуктов питания, больного и (или) бактерионосителя).
Выделение чистой культуры . Включает 3 или 4 этапа:
1. Посев материала (после предварительной микроскопии) на чашку с плотной питательной средой (лучше дифференциально-диагностической или селективной) с целью получения изолированных колоний. Производят его чаще всего методом механического разобщения. В некоторых случаях (например, кровь) материал предварительно засевают в жидкую среду обогащения с последующим пересевом на чашку с агаровой средой. Иногда до посева проводят селективную обработку материала (с учетом свойств выделяемого микроорганизма; например, обработка кислотой или щелочью для выделения устойчивых бактерий). Культивируют при температуре 37°С в течение 18-24 часов. Время культивирования для разных видов бактерий может колебаться.
2(3):а) изучение колоний на чашке с агаром (культуральные признаки), отбор наиболее типичных; б) приготовление мазков из этих колоний с окраской (по Граму или другими методами); а) отсев остатка исследованной колонии на среду накопления и выращивание в термостате при оптимальной температуре.
3(4). Изучение чистоты культуры, полученной на среде накопления. С этой
целью готовят мазок, окрашивают (чаще по Граму), микроскопически изучают
морфологическую и тинкториальную однородность (в разных полях зрения).
4(5). Идентификация чистой культуры.
Заключение. По совокупности признаков в сравнении со свойствами эталонных (типовых) штаммов указывается вид выделенного из материала микроорганизма.
Оценка метода:
достоинства: относительно высокая чувствительность и точность, возможность определить численность микробов в исследуемом материале, а также чувствительность к антибиотикам; недостатки: относительная длительность, метод дорогостоящий.
21. Питательные среды для аэробов и анаэробов. Требования, предъявляемые к питательным средам, классификация.
Требования:
1. среды должны быть питательными
2. должны иметь определенные ph
3. должны быть изотоническими, т.е. осмотическое давление в среде должго быть такое же как в клетке.
4. должны быть влажными и не слишком жидкими
5. должны облпдпть определенным окислительно-восстановительным потенциалом
6. должны быть стерильными
7. должны быть унифицированными, т.е. содержать постоянные количества отдельных ингредиентов.
Питательные среды можно разделить:
А) По происхождению:
1} естественные - натуральные продукты питания (мясо, молоко, картофель);
2) искусственные - приготовленные специально для выращивания микробов: - среды из естественных продуктов (мясная вода, мясопептонный бульон (МПБ), мясопептонный агар (МПА), - не имеющие постоянного состава; - синтетические питательные среды - растворы строго определенных количеств солей, аминокислот, азотистых оснований, витаминов в дистиллированной воде - имеют постоянный состав, используются для выращивания микроорганизмов и культур клеток при получении вакцин, иммунных сывороток и антибиотиков;
Б) По назначению:
1) общего назначения (МПБ, МПА) - на них растет большинство микробов;
2) элективные - избирательно способствуют росту одного вида микробов из смеси (например, желточно-солевой агар для стафилококков);
ЗАНЯТИЕ № 4
ТЕМА: ФИЗИОЛОГИЯ МИКРООРГАНИЗМОВ. БАКТЕРИОЛОГИЧЕСКИЙ (КУЛЬТУРАЛЬНЫЙ) МЕТОД ИССЛЕДОВАНИЯ. БИОХИМИЧЕСКИЕ СВОЙСТВА МИКРООРГАНИЗМОВ.
ПЕРЕЧЕНЬ КОНТРОЛЬНЫХ ВОПРОСОВ
Питание бактерий. Питательные вещества – источники углерода и азота. Классификация бактерий по типам питания Аутотрофы и хемоорганотрофы
Факторы роста и их источники. Источники минеральных элементов.
Способы и механизмы переноса питательных веществ через мембрану.
Энергетические потребности бактерий. Пути получения энергии у аутотрофов (фотосинтез, хемосинтез). Источники и пути получения энергии у хемоорганотрофов.
Аэробный и анаэробный типы биологического окисления у бактерий. Аэробные, анаэробные, факультативно анаэробные и микроаэрофильные бактерии. Способы создания анаэробных условий.
Задачи, этапы, преимущества и недостатки бактериологического (культурального) метода исследования.
Рост и размножение микроорганизмов. Способы размножения. Бинарное (простое) деление, механизм. Размножение бактериальных популяций.
Принципы и методы культивирования бактерий. Питательные потребности микробов.
Питательные среды для культивирования бактерий. Требования к питательным средам. Классификация питательных сред.
Условия и техника культивирования бактерий. Техника посева на питательные среды. Закономерности и характер роста бактерий на плотных и жидких питательных средах.
Способы выделения чистых культур аэробных и анаэробных бактерий.
Свойства, используемые для идентификации выделенных культур.
САМОСТОЯТЕЛЬНАЯ И ЛАБОРАТОРНАЯ РАБОТА
Бактериологический метод (этапы):
1 1-й этап выделения чистой культуры аэробных бактерий: А) Микроскопия патологического материала.
Окраска мазков из патологического материала по Граму. Зарисовка препарата.
Б) Освоение под руководством преподавателя техники посева патологического материала бактериологической петлей и шпателем на пластинчатые питательные среды.Посев патологического материала бактериологической петлей на пластинчатый мясопептонный агар (МПА) для получения изолированных колоний.
Классификация питательных сред (указать области применения)
1. По консистенции: жидкие (мясо- пептонный бульон, желчный, сахарный бульон), плотные (2- 3% агара) и полужидкие (0,15- 0,7 % агара) среды.
2. По происхождению: естественные - из молока, мяса. яиц, картофеля, сыворотки крови человека, животных и др продуктов; искусственные – 1) натуральные сбалансированные смеси питательных веществ в концентрациях и сочетаниях, необходимых для роста и размножения микроорганизмов, универсальный источник азота и углерода - пептоны - продукты неполного расщепления белков с помощью пепсина или различные гидролизаты (рыбный, казеиновый, дрожжевой и др.).2) синтетические c точным химическим составом Сотона для микобактерий, 199 для клеток.
3. По составу: простые питательные среды (мясо- пептонный бульон- МПБ, мясо- пептонный агар- МПА) и с ложные (КА = МПА +5- 10% крови животных)
4. По назначению:
А) Общего назначения - универсальные, предназначенные для культивирования любых микроорганизмов (МПА,КА)
Б) Специальные для выращивания микроорганизмов не растущих на универсальных средах, дифференциации видов и избирательного выделения отдельных видов микроорганизмов:
элективные (селективные) для выделения определенных видов микроорганизмов и подавления роста сопутствующих – (солевой агар для стафилококков).
дифференциально-диагностические (ДДС) -среды, позволяющие различать виды бактерий по ферментативной активности; Они с одержат: 1) универсальную питательную среду (МПА, КА); 2)дифферецирующий фактор - химический субстрат (например, углевод), различное отношение к которому является диагностическим признаком для данного микроба.3) Индикатор, изменение цвета которого свидетельствует о биохимической реакции. (среды Эндо, Плоскирева, Гисса и другие).
дифференциально-селективные (ДС) - среды, позволяющие выделять бактерии определенного вида по их физиологическим особенностям и дифференцировать от других видов по ферментативной активности Они содержат: 1) МПА 2) элективный химический субстрат, препятствующий росту других видов бактерий . 3)дифферецирующий фактор - субстрат, отношение к которому является диагностическим признаком для данного микроба;) 4.) Индикатор, изменение цвета которого свидетельствует о биохимической реакции. (среды ЖСА для стафилококков, ВСА для сальмонелл, Плоскирева для шигелл и сальмонелл).
В) Обогащения среды для размножения и накопления бактерий определенного вида в клиническом материале (кровь в 20% желчном бульоне =сальмонеллы, отделяемое зева в 10 % сывороточном+ 2 % теллурита = коринебактерии.)
Г) Транспортные среды для забора и доставки (консервации) клинического материала =48 часов (Среда Амиеса –полужидкий агар+уголь активированный).)
Питательные среды (примеры):
Среда Эндо Тип среды дифференциально-диагностическая для энтеробактерий Питательная основа МПА Дифференцирующий фактор лактоза 1% Индикатор основной фуксин, обесцвеченный сульфитом натрия. Е.с oli разлагают лактозу до кислоты –колонии красные с металлическим блеском, патогенные бесцветные;
Солевой агар Тип среды элективная для выделения стафилококков Питательная основа МПА Элективный фактор хлористый натрий 10%
Среда Плоскирева Тип среды дифференциально-селективная для энтеробактерий
Питательная основа МПА Элективный фактор соли желчных кислот Дифференцирующий фактор лактоза
Индикатор нейтральный красный
Желточно-солевой агар Тип среды дифференциально-селективная для S . aureus _
Питательная основа МПА Элективный фактор хлористый натрий 10%
Дифференцирующий фактор яичный желток
Индикатор нет
2 2 этап бактериологического метода исследования (выделение чистой культуры):
А) Изучение изолированных колоний (эшерихий, стафилококка) на пластинчатом МПА.
|
Изучаемые культуральные свойства |
1 тип колоний |
2 тип колоний |
|
Форма колонии |
Правильной формы, круглые |
Правильной формы |
|
Консистенция |
однородные |
однородные |
|
Размер колонии |
средние (размером 2-4 мм) | |
|
Характер края |
с ровными краями |
с ровными краями |
|
Характер поверхности |
выпуклые |
Б) Приготовление мазков из отобранных колоний (окраска по Граму).
В) Пересев изолированных колоний на скошенный МПА для накопления чистой культуры.
3 Выделение чистой культуры анаэробных бактерий: посев суспензии почвы на среду Китта-Тароцци для выделения патогенных клостридий
Среда Китт- Тароцци состоит из питательного бульона, 0,5% глюкозы и кусочков печени или мясного фарша для поглощения кислорода из среды. Перед посевом среду прогревают на кипящей водяной бане в течение 20 - 30 минут для удаления воздуха из среды. После посева питательную среду сразу заливают слоем парафина
Методы создания анаэробиоза:
1.Физический- откачивание воздуха, введение специальной газовой безкислородной смеси (чаще- N 2 - 85%, CO 2 - 10%, H 2 - 5%), предварительное кипячение питательных сред, посев в глубокий столбик агара, заливка сред вазелиновым маслом для сокращения доступа кислорода, использование герметически закрывающихся флаконов и пробирок, шприцев и лабораторной посуды с инертным газом, использование плотно закрывающихся эксикаторов с горящей свечой
2. Химический- применяют химические поглотители кислорода.
3. Биологический - совместное культивирование строгих аэробов и анаэробов (аэробы поглощают кислород и создают условия для размножения анаэробов – метод Фортнера).
Среда Китт - Тароцци состоит из питательного бульона, 0,5 % глюкозы и кусочков печени или мясного фарша для поглощения кислорода из среды. Перед посевом среду прогревают на кипящей водяной бане в течение 20 - 30 минут для удаления воздуха из среды. После посева питательную среду сразу заливают слоем парафина или вазелинового масла для изоляции от доступа кислорода.
4. Смешанный - используют несколько разных подходов.
Используются специальные приборы для создания анаэробных условий - анаэростаты. В настоящее время наиболее простым и эффективным оборудованием для создания анаэробных и микроаэрофильных условий является химический метод со специальными пакетами, действующими по принципу поглощения атмосферного кислорода в герметически закрытых емкостях .
Среда Вильсона-Блера (пробирки,чашки):
Питательная основа МПА Дыхательный субстрат глюкоза
Редуцирующий фактор сульфит натрия и двуххлористое железо сульфит-натрия Na 2 SO 3 → Na 2 S
Для среды Вильсона - Блера базой является агар с добавлением глюкозы , Клостридии образуют на этой среде колонии чёрного цвета за счет восстановления сульфита до сульфид - аниона , который соединяясь с катионами железа (II) дает соль чёрного цвета. Как правило, черные на этой среде образования колонии , появляются в глубине агарового столбика .
Тиогликолевая среда (среда для контроля стерильности): (пробирки):
Питательная основа МПБ Дыхательный субстрат глюкоза Редуцирующий фактор тиогликолят натрия
Индикатор резазурин
Глюкозо-кровяной агар Цейсслера: (чашки): Питательная основа МПА, кровь
Дыхательный субстрат глюкоза Редуцирующий фактор гемоглобин
Термин «анаэробы» ввел Луи Пастер , открывший в 1861 году бактерии маслянокислого брожения .
А Лекция 3 Физиология микроорганизмов. Метаболизм бактерий .
Физиология микроорганизмов включает:
типы питания;
типы дыхания;
культивирование (условия, среды, характер и скорость роста);
биохимическую активность;
изменчивость;
выделение биологически активных веществ, токсинов и других факторов патогенности;
чувствительность к антибиотикам, бактериофагам, бактериоцинам;
другие биологические свойства.
Метаболизм бактерий – совокупность физико-химических процессов (химических превращений и реакций), направленных на воспроизводство структур и обеспечение жизненных функций микробной клетки, таких как:
рост и размножение;
отложение резервного пищевого материала;
транспорт питательных веществ в микробную клетку;
выделение продуктов метаболизма (токсинов, ферментов, антибиотиков и других биологически активных веществ);
движение;
спорообразование;
адгезия на чувствительных рецепторах клеток хозяина и проникновение в них;
различных адаптивных реакций на изменение внешней среды.
Анаболизм - совокупность биохимических реакций, осуществляющих синтез компонентов клетки.
Катаболизм - совокупность реакций, обеспечивающих клетку энергией.
Схема изучения метаболизма – этапы:
1. Начальный (периферический) метаболизм – проникновение веществ в клетку извне и распад до промежуточных продуктов.
2. Амфиболизм (промежуточный метаболизм) – образование промежуточных продуктов метаболизма, общих для катаболических и анаболических путей.
3. Конечные, строго специализированные этапы конструктивного метаболизма (ведут к построению структур клетки) и энергетического метаболизма (образование АТФ).
Механизмы проникновения питательных веществ в клетку:
Простая диффузия (для истинных растворов). Энергонезависимый процесс.
Облегченная диффузия («паром по течению») – в направлении градиента концентрации с участием белков – переносчиков. Энергозависимый процесс.
Активный транспорт – против концентрационного и электрохимического градиента с участием пермеаз (амино-, оксикислотных, ионных и др.). Процесс идет с затратой энергии АТФ, зависит от заряда веществ и их трансформации в процессе переноса.
Микроорганизмы по способности усваивать источники углерода делятся на две группы: автотрофы (лат. autos - сам,trophe - питание) синтезируют все углеродсодержащие компоненты клетки из СО 2 как единственного источника углерода и гетеротрофы (лат.heteros - другой, «питающийся за счет других») используют разнообразные органические углеродсодержащие соединения.
В зависимости от источников энергии и микроорганизмы подразделяют на фототрофы (фотосинтезирующие), способные использовать солнечную энергию, и хемотрофы (хемосинтезирующие), получающие энергию за счет окислительно-восстановительных реакций.
В зависимости от используемых доноров электронов бактерии разделяют на литотрофы (используют неорганические доноры электронов) и органотрофы (используют органические соединения).
Прототрофы - микроорганизмы, способные синтезировать все необходимые им органические соединения из глюкозы и солей аммония.
Ауксотрофы - микроорганизмы, не способные синтезировать какие-либо органические соединения. Они получают эти соединения в готовом виде из окружающей среды или организма человека.
Ферменты (от греч.fermentum-закваска) -высокоспецифические белковые катализаторы, присутствующие во всех живых клетках, без которых не возможны жизнь и размножение. Ферменты распознают соответствующие им метаболиты (субстраты), вступают с ними во взаимодействие и ускоряют химические реакции. Ферменты являются белками.
Ферментный состав микроорганизма определяется геномом и является достаточно стабильным признаком. Определение ферментов широко применяется для биохимической идентификации бактерий.
Эндоферменты катализируют метаболизм проходящий внутри клетки.
Экзоферменты выделяются клеткой в окружающую среду.
Конститутивные ферменты постоянно синтезируются в определенных концентрациях.
Индуцибельные ферменты – это ферменты, концентрация которых увеличивается при поступлении соответствующего субстрата.
Ферменты агрессии: гиалуронидаза, фибринолизин, нейраминидаза, коллагеназа, лецитиназа (лицитовителлаза), коагулаза, уреаза, аминокислотные декарбоксилазы, дезоксирибонуклеаза.
Культивирование – получение культур микроорганизмов в условиях искусственной питательной среды.
Цели культивирования:
получение чистых культур патогенных микроорганизмов и их идентификация;
накопление биомассы продуцентов БАВ (витаминов, гормонов, аминокислот, антибиотиков и др.);
получение диагностических и профилактических препаратов (вакцин, диагностикумов);
хранение эталонных музейных культур;
в санитарной микробиологии для определения санитарно-показательных микроорганизмов – индикаторов загрязненности окружающей среды.
Культура – популяция микроорганизмов, выращенная на питательной среде.
Чистая культура – популяция одного вида микроорганизмов, выращенная из изолированной колонии на питательной среде.
Большинство патогенных микробов выращивают на питательных средах при температуре 37°С в течение 1-2 сут.
Классификация питательных сред
По консистенции: жидкие, полужидкие, плотные.
По происхождению: естественные (молоко, картофель), искусственные, полусинтетические, синтетические
По составу: простые (МПА, МПБ, овощи, молоко), сложные (1% глюкозы, 10-20% сыворотки крови, 20-30% асцитической жидкости,5-10% дефибринированной крови).
По назначению:
универсальные - среды, на которых хорошо растут многие виды бактерий. К ним относятся мясо-пептонный бульон (МПБ) и мясо-пептонный агар (МПА);
специальные - среды, специально приготовленные для получения роста бактерий, которые не растут на универсальных средах;
дифференциально-диагностические - среды, позволяющие отличать одни виды бактерий от других по ферментативной активности;
селективные - среды, содержащие вещества, используемые микроорганизмами определенных видов и препятствующие росту других микроорганизмов. Селективные среды позволяют направленно отбирать из исследуемого материала определенные виды бактерий;
дифференциально-селективные - среды, сочетающие в себе свойства дифференциально-диагностических и селективных сред;
консервирующие;
обогатительные.
Размножение бактерий на жидких и плотных питательных средах.
Рост координированное воспроизведение всех компонентов бактериальной клетки и увеличение ее биомассы.Размножение – воспроизводство и увеличение количества клеток, приводящее к образованию бактериальной популяции.
Бактерии характеризуются высокой скоростью размножения. Скорость размножения зависит от видовой принадлежности, состава питательной среды, рН, температуры, аэрации.
На плотных питательных средах бактерии образуют скопления клеток, называемые колониями. Колонии разных видов отличаются по размерам, форме, консистенции, окраске, характеру краев, характеру поверхности, прозрачности.
Характер роста на жидких питательных средах: пленочный (образованием пленки на поверхности питательной среды), диффузное помутнение, придонный (образование осадка).
Фазы развития бактериальной популяции
Исходная стационарная фаза (~ 1-2 ч.). Число бактерий не увеличивается, клетки не растут.
Лаг-фаза или фаза задержки размножения (~ 2ч.).
Log-фаза - логарифмическая или экспоненциальная фаза (~ 3-5ч). Популяция делится с максимальной скоростью и идет увеличение особей в геометрической прогрессии.
Фаза отрицательного ускорения (~ 2ч.). Связана с истощением лимитирующего метаболита или накоплением токсических продуктов метаболизма.
Стационарная фаза максимума. Количество образующихся и отмирающих клеток одинаково.
Фаза ускоренной гибели (~ 3 ч.).
Логарифмическая фаза гибели (~ 5).
Фаза уменьшения скорости отмирания – остающиеся живые особи переходят в состояние покоя.
Энергетический метаболизм бактерий
Аэробы - микроорганизмы, использующих аэробный (окислительный) тип биологоческого окисления субстратов. Метаболизм аэробов осуществляется только при наличии в среде обитания высокой концентрации свободного кислорода, который выполняет функцию конечного акцептора отнятых от субстрата электронов. Культивирование аэробов осуществляют на средах с полным доступом кислорода воздуха.
Облигатные анаэробы - микроорганизмы, использующая анаэробный тип биологического окисления (брожение). Метаболизм осуществляется только в средах с низким окислительно-востановительным потенциалом при отсутствии кислорода.
Повышение концентрации кислорода в среде ведет к гибели вегетативных форм.
Количество извлекаемой в процессе брожения энергии невелико, поэтому облигатные анаэробы вынуждены сбраживать большое количество субстрата.
Факультативные анаэробы - микроорганизмы, способные извлекать энергию из субстратов аэробным (окислительным) и анаэробным (бродильным) путями биологического окисления. Метаболизм может осуществляться как в условиях полного доступа кислорода в среду, так и в условиях анаэробиоза.
Методы создания анаэробиоза
Физические
посев в столбик сахарного МПА;
кипячение (регенерация) жидких питательных сред с последующим масляным покрытием;
механическое удаление кислорода в анаэростатах;
замена кислорода индиферентным газом;
трубки Вейона-Виньяля.
Химические
аппарат Аристовского;
свеча Омелянского (щелочной р-р пирогаллола);
использование химических акцепторов кислорода: глюкозы, пировиноградной кислоты, муравьинокислого натрия и др.
Биологические
среда Китта-Тароцци
метод Фортнера
Анаэробы - организмы, получающие энергию при отсутствии доступа кислорода путем субстратного фосфорилирования , конечные продукты неполного окисления субстрата при этом могут быть окислены с получением большего количества энергии в виде АТФ в присутствии конечного акцептора протонов организмами, осуществляющими .
Анаэробное дыхание - совокупностьбиохимических реакций , протекающих в клетках живых организмов при использовании в качестве конечного акцептора протонов некислорода , а других веществ (например,нитратов ) и относится к процессамэнергетического обмена (катаболизм ,диссимиляция ), которые характеризуютсяокислением углеводов ,липидов иаминокислот до низкомолекулярных соединений.
А эробные
и анаэробные бактерии предварительно
идентифицируются в жидкой питательной
среде по градиенту концентрации O2:
эробные
и анаэробные бактерии предварительно
идентифицируются в жидкой питательной
среде по градиенту концентрации O2:
1. Облигатные аэробные (нуждающихся в кислороде) бактерии в основном собираются в верхней части пробирки, чтобы поглощать максимальное количество кислорода. (Исключение: микобактерии - рост пленкой на поверхности из-за восколипидной мембраны.)
2. Облигатные анаэробные бактерии собираются в нижней части, чтобы избежать кислорода (либо не дают роста). 3.Факультативные бактерии собираются в основном в верхнем (окислительное фосфорилирование является наиболее выгодным, чем гликолиз), однако они могут быть найдены на всем протяжении среды, так как от O 2 не зависят. 4. Микроаэрофилы собираются в верхней части пробирки, но их оптимум - малая концентрация кислорода. 5.Аэротолерантные анаэробы не реагируют на концентрации кислорода и равномерно распределяются по пробирке.
Д ля
измеренияпотенциала
средыМ.
Кларк
предложил использовать
величину pH20 - отрицательныйлогарифм
парциального
давления
газообразноговодорода
.
Диапазон характеризует все степени
насыщения водного раствора водородом
и кислородом. Аэробы растут при более
высоком потенциале , факультативные
анаэробы , а облигатные - при
наиболее низком .)
ля
измеренияпотенциала
средыМ.
Кларк
предложил использовать
величину pH20 - отрицательныйлогарифм
парциального
давления
газообразноговодорода
.
Диапазон характеризует все степени
насыщения водного раствора водородом
и кислородом. Аэробы растут при более
высоком потенциале , факультативные
анаэробы , а облигатные - при
наиболее низком .)
Классификация анаэробов , различают:
Факультативные анаэробы
Капнеистические анаэробы и микроаэрофилы
Аэротолерантные анаэробы
Умеренно-строгие анаэробы
Облигатные анаэробы
Если организм способен переключаться с одного метаболического пути на другой (например, с анаэробного дыхания на аэробное и обратно), то его условно относят к факультативным анаэробам .
До 1991 года в микробиологии выделяли класс капнеистических анаэробов, требовавших пониженной концентрации кислорода и повышенной концентрации углекислоты (Бруцеллы бычьего типа - B. abortus)
Культуральный (бактериологический) метод исследования - совокупность способов, направленных на выделение и идентификацию чистых культур микроорганизмов (бактерий) с помощью культивирования на питательных средах.
Чистая культура - совокупность микроорганизмов одного вида. Чаще всего чистую культуру получают путем отбора и культивирования изолированной колонии (потомство одной микробной клетки).
Этапы метода:
1. Забор материала для исследования.
2. Выделение чистой культуры и ее идентификация.
3. Заключение.
Забор материала для исследования. Вид исследуемого материала зависит от цели исследования (диагностика - от больного; эпиданализ - из внешней среды, продуктов питания, больного и (или) бактерионосителя).
Выделение чистой культуры . Включает 3 или 4 этапа:
1. Посев материала (после предварительной микроскопии) на чашку с плотной питательной средой (лучше дифференциально-диагностической или селективной) с целью получения изолированных колоний. Производят его чаще всего методом механического разобщения. В некоторых случаях (например, кровь) материал предварительно засевают в жидкую среду обогащения с последующим пересевом на чашку с агаровой средой. Иногда до посева проводят селективную обработку материала (с учетом свойств выделяемого микроорганизма; например, обработка кислотой или щелочью для выделения устойчивых бактерий). Культивируют при температуре 37°С в течение 18-24 часов. Время культивирования для разных видов бактерий может колебаться.
2(3):а) изучение колоний на чашке с агаром (культуральные признаки), отбор наиболее типичных; б) приготовление мазков из этих колоний с окраской (по Граму или другими методами); а) отсев остатка исследованной колонии на среду накопления и выращивание в термостате при оптимальной температуре.
3(4). Изучение чистоты культуры, полученной на среде накопления. С этой
целью готовят мазок, окрашивают (чаще по Граму), микроскопически изучают
морфологическую и тинкториальную однородность (в разных полях зрения).
4(5). Идентификация чистой культуры.
Заключение. По совокупности признаков в сравнении со свойствами эталонных (типовых) штаммов указывается вид выделенного из материала микроорганизма.
Оценка метода:
достоинства: относительно высокая чувствительность и точность, возможность определить численность микробов в исследуемом материале, а также чувствительность к антибиотикам;недостатки: относительная длительность, метод дорогостоящий.
21. Питательные среды для аэробов и анаэробов. Требования, предъявляемые к питательным средам, классификация.
Требования:
среды должны быть питательными
должны иметь определенные ph
должны быть изотоническими, т.е. осмотическое давление в среде должго быть такое же как в клетке.
должны быть влажными и не слишком жидкими
должны облпдпть определенным окислительно-восстановительным потенциалом
должны быть стерильными
должны быть унифицированными, т.е. содержать постоянные количества отдельных ингредиентов.
Питательные среды можно разделить:
А) По происхождению:
1} естественные - натуральные продукты питания (мясо, молоко, картофель);
2) искусственные - приготовленные специально для выращивания микробов: - среды из естественных продуктов (мясная вода, мясопептонный бульон (МПБ), мясопептонный агар (МПА), - не имеющие постоянного состава; - синтетические питательные среды - растворы строго определенных количеств солей, аминокислот, азотистых оснований, витаминов в дистиллированной воде - имеют постоянный состав, используются для выращивания микроорганизмов и культур клеток при получении вакцин, иммунных сывороток и антибиотиков;
Б) По назначению:
1) общего назначения (МПБ, МПА) - на них растет большинство микробов;
2) элективные - избирательно способствуют росту одного вида микробов из смеси (например, желточно-солевой агар для стафилококков);
3) дифференциально-диагностические - позволяют отдифференцировать по внешнему виду среды один вид микроба от других (например среды Эндо, Левина для кишечной группы микробов).
Кроме того, в зависимости от целей использования в схеме выделения чистых культур, по назначению можно выделить следующие среды:
1) обогащения - подавляют рост микробов, сопутствующих возбудителю;
2) для получения изолированных колоний;
3) накопления чистой культуры;
В) По консистенции:
1) жидкие;
2) полужидкие (при добавлении агар-агара в концентрации 0,5-0,7%);
3) плотные - выше 1%.
В соответствии с современными программами ВОЗ, основой выявления туберкулёза за рубежом считают проведение микроскопии мазков мокроты, полученной от кашляющих больных, обратившихся к врачам общей практики; мазки окрашивают по Цилю-Нильсену. Эта методика входит в отечественный поликлинический и клинический минимум обследования пациента, выделяющего мокроту. В 1995 г. Минздравмедпром России в приказе № 8 "О развитии и совершенствовании деятельности лабораторной клинической микробиологии (бактериологии) лечебно-профилактических учреждений" подтвердил эту обязанность клинико-диагностических лабораторий. Обязательное бактериологическое исследование мокроты на М. tuberculosis должно быть организовано для нетранспортабельных больных, больных хроническими заболеваниями органов дыхания и мочевыводящей системы, а также для работников неблагополучных по туберкулёзу животноводческих хозяйств. Этот старейший метод полностью сохраняет свое значение вследствие доступности для практических клинико-диагностических лабораторий, низкой стоимости и быстроты выполнения.
При бактериоскопии мазка, окрашенного по Цилю-Нильсену, микобактерии туберкулеза могут быть обнаружены при наличии не менее 100 000 - 1 000 000 бактериальных клеток в 1 мл патологического материала (мокроты). Такое большое количество микобактерий встречается у больных с далеко зашедшими прогрессирующими формами заболевания (диссеминированными и фиброзно-кавернозными). У значительно большего числа больных количество выделяемых ими микобактерий ниже предела метода бактериоскопии, что и является большим минусом этого метода. Только при идеальном выполнении всех требуемых условий, указанных в Приказе № 109 МЗ РФ,-исследование не менее трех проб диагностического материала, правильный сбор мокроты, наличие современного бинокулярного микроскопа и высококачественных реактивов, просмотр до 300 полей зрения - возможно повышение чувствительности до 10000 микробных клеток.
Микобактерии туберкулёза имеют вид тонких, слегка изогнутых палочек различной длины с утолщениями на концах или посередине, располагаются группами и поодиночке (рисунок 1,а) Окрашенные по Цилю-Нильсену мазки микроскопируют с иммерсионной системой не менее 10 мин.
Люминесцентная микроскопия
Метод основан на проникновении в микробную клетку карболового производного флюоресцентного красителя (аурамина, родамина). При окраске флюоресцентным красителем аурамином-родамином микобактерии можно видеть при неиммерсионном 100-кратном увеличении. Более точен результат при окраске по Цилю-Нильсену карболфуксином и иммерсионной микроскопии при 1000-кратном увеличении. Именно окраска мазка по Цилю-Нильсену рекомендована при применении технологий DOTS. Микобактерии в этом случае выглядят светящимися желтыми палочками (рисунок 1, б). Метод имеет неоспоримые преимущества, так как позволяет при меньшем увеличении микроскопа просмотреть фактически весь мазок, так же этот метод экономически более эффективен, так как уменьшается время, затрачиваемое на просмотр мазков.
К недостаткам метода ЛМ следует отнести значительно более высокую стоимость люминесцентного микроскопа, при процедуре окрашивания- соблюдение и коррекция pH мазка, а также освобождение микобактерий в диагностическом материале (особенно в мокроте) от окружающей их слизи, которая препятствует проникновению флуоресцентного красителя в микробную клетку. Поэтому нецелесообразно использование ЛМ для нативной мокроты, но применять этот метод рекомендуется при исследовании мазков, приготовленных после центрифугирования из осадка материала, обработанного для культурального исследования и нейтрализованного после деконтаминации. Поэтому метод ЛМ следует применять в бактериологических лабораториях, где культуральное и микроскопическое исследование может быть произведено из одной и той же порции диагностического материала.
При гистологическом или цитологическом исследовании иногда можно обнаружить характерные для туберкулёза клетки, являющиеся результатом защитной реакции организма на внедрение туберкулёзной палочки. Наличие в цитограмме гигантских клеток Лангханса с несомненностью решает диагноз туберкулёза. Эти клетки имеют очень большие размеры (80 - 90 мкм и более в диаметре). Цитоплазма окрашена в серо-голубой цвет. По её периферии расположено в ряд большое количество ядер (до 20), расположенных в форме кольца (рисунок 1, в).
Другим признаком туберкулёза является присутствие в препарате так называемых эпителиоидных клеток, из которых и развиваются клетки Лангханса. Это происходит при увеличении количества ядер без разделения цитоплазмы, которая только увеличивается в размерах (рисунок 1, г).
Микроскопия позволяет быстро получить результат, но обладает низкой чувствительностью и специфичностью, невозможностью дифференциации кислотоустойчивых микобактерий.
Рисунок 1 - Микобактерии туберкулеза
а - метод окраски по Цилю-Нельсену
б - метод люминисцентной микроскопии
в - клетки Лангхаса
г - эпителиоидные клетки
Культуральный метод
Наиболее распространенным методом выявления микобактерий туберкулеза в нашей стране является культуральный метод. Это "золотой стандарт" бактериологической диагностики туберкулеза, так как чувствительность метода существенно выше микроскопического и дает возможность получить чистую культуру микобактерий для её последующей идентификации и исследования лекарственной устойчивости. Этот метод дает положительные результаты при наличии в исследуемом материале от 20 до 100 жизнеспособных микробных клеток в 1 мл. Однако он трудоемок и длителен в связи с тем, что микобактерии туберкулеза растут очень медленно и их обнаружение может быть зарегистрировано только через 3 недели культивирования.
Исторически сложилось, что питательные среды на яичной основе (Левенштейна-Йенсена, Финна-2, Огавы, Аникина, "Новая", Попеску) получили наибольшее распространение среди плотных питательных сред, применяемых для выделения МБТ. Посев материала на среду Левенштайна-Йенсена проводят в бактериологической лаборатории. Рост первых колоний на классических средах отмечают через 4 - 8 недель. Однако появившиеся в последние годы агаровые среды Миддлбрука (7Н10, 7Н11) позволяют быстрее обнаружить рост микобактерий (от двух до четырех недель) и обеспечивают лучшие возможности для изучения морфологии колоний, чем на яичных средах. Недостатком агаризованных питательных сред является необходимость инкубации посевного материала в термостате с углекислым газом, поэтому агаризованные среды в России практически не применяются.
Следует отметить, что в связи с высокой избирательностью различных штаммов микобактерий и потребностью в полноценных белках до сих пор нет универсальной питательной среды , способной заменить все остальные. В Приказе № 109МЗ РФ для посева диагностического материала на МБТ рекомендуется использовать по одной пробирке международной питательной среды Левенштейна-Йенсена и Финна-2. Однако практика показывает, что кроме указанных сред целесообразно использовать и какую-либо из дополнительных, а посев на три пробирки питательной среды также повышает эффективность культуральной диагностики.
Для полноценной культуральной диагностики туберкулеза необходимо иметь соответствующие помещения и оборудование. Особенно важно наличие центрифуги и антиаэрозольной защитой и способностью обеспечить ускорение 3000g. А также шкафов биологической безопасности для предотвращения внутрилабораторного инфицирования.
Основным недостатком культуральной диагностики туберкулеза является длительность исследования - от трех недель до трех месяцев. Поэтому остаются актуальными дальнейшие исследования по разработке методов ускорения роста микобактерий.
Системы BACTEC
Культуральная диагностика туберкулеза переживает в настоящее время принципиальные изменения, связанные с внедрением в практику полностью автоматизированных систем культивирования МБТ. Главное отличие этих методов - применение жидких питательных сред для культивирования с последующей радиометрической (BACTEC 460), колорометрической (Mb-Bact, Вас- tALERT) и люминесцентной детекцией роста (BACTEC MGIT 960). Рост МБТ на жидкой питательной среде в этих системах удается обнаружить уже через 1 - 2 недели в зависимости от их исходного количества в диагностическом материале. Частота выявления микобактерий так же несколько выше, чем на плотных питательных средах. Автоматизированные системы BACTEC с использованием соответствующих флаконов, содержащих различные противотуберкулезные препараты, позволяют сократить время исследования лекарственной устойчивости микобактерий до 10 - 14 суток.
Из перечисленных автоматизированных систем наиболее эффективна в настоящее время система BACTEC MGIT 960BD. Флаконы MGIT с жидкой питательной средой 7Н9 содержат в придонной части под силиконом флуоресцентный индикатор, "погашенный" высокими концентрациями кислорода. При наличии роста микобактерий в процессе поглощения кислорода индикатор начинает светиться, регистрация флуоресценции в сисиеме BACTEC MGIT производится автоматически. Использование флаконов MGIT возможно и "вручную", тогда регистрацию свечения производят с помощью трансиллюминатора на флаконах MGIT составляет 11 суток.