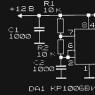
Особенности проведения мау анализа. О каких нарушениях свидетельствует микроальбумин в моче? Как сдавать анализ на микроальбуминурию? Что такое мау в медицине
Увидев результаты лабораторного исследования, пациент, естественно, хочет разобраться: что там - норма или нет? Но читать анализ, увы, умеют далеко не все. Хотя ничего особенно сложного тут нет. Общий анализ мочи - ОАМ - самый распространенный, старый и рутинный инструмент диагностики. Однако несмотря на это, он по сей день не потерял своей актуальности.
В общий анализ этой биологической жидкости входят:
- оценка ее физических параметров;
- определение наличия органических веществ;
- микроскопическое исследование осадка.
Оценка физических параметров
Цвет, прозрачность, запах мочи. У здорового человека она желтого цвета различной интенсивности. Коричневая и даже почти черная моча бывает при гемолитических анемиях, злокачественных опухолях, тяжелых алкогольных и химических отравлениях. Красноватой она становится при травмах, острых воспалениях, инфаркте почек. Розоватой - если нарушена выработка гемоглобина. Бесцветная или бледно-желтая моча бывает у диабетиков. Молочный цвет сигнализирует о наличии гноя, жиров, фосфатов в высокой концентрации.
Однако розовый, красный или коричневый оттенки моча может приобрести из-за свеклы, моркови, препаратов железа, «5-НОК». А зеленый или светло-коричневый цвет - из-за лаврового листа, ревеня. Но это все не патологические, а физиологические показатели цвета, то есть норма.
Свежая моча здорового человека прозрачна. Лишь со временем она мутнеет, так как начинают осаждаться растворенные в ней соли и другие примеси. Это тоже норма. Чем выше концентрация примесей, тем моча мутнее.
У нее всегда специфический запах, не слишком резкий. Если же моча пахнет аммиаком, это, как правило, сигнализирует о воспалительных процессах в почках или мочевом пузыре. Яблоками она отдает обычно у диабетиков. Запах мочи становится резким, когда человек потребляет продукты или принимает лекарства, богатые душистыми веществами. В таком случае патологии нет.
Кислотность мочи. Если питание разнообразное и сбалансированное, то реакция мочи либо нейтральная (7,0), либо слабокислая (менее 7,0). Ярко выраженную кислую реакцию она приобретает при лихорадке, вызванной высокой температурой, камнях в мочевом пузыре, заболеваниях почек. Значительная щелочная реакция появляется при рвоте, диарее, острых воспалительных процессах, инфекциях мочевых путей, распаде раковых опухолей.
Относительная плотность. Этот важный параметр - sg в латинской транскрипции - характеризует концентрационную функцию почек. Он определяется как удельный вес жидкости и в норме составляет 1003-1028 единиц. Его колебания по физиологическим причинам допускаются в пределах 1001-1040 единиц. У мужчин удельный вес мочи выше, чем у женщин и детей.
При патологиях наблюдаются его устойчивые отклонения. Так при сильных отеках, диарее, остром гломерулонефрите, диабете отмечается гиперстенурия, когда удельный вес превышает 1030 единиц.
Показатель невысокой относительной плотности - 1007-10015 единиц - свидетельствует о гипостенурии, которая может быть вызвана голоданием, несахарным диабетом, нефритами. А если удельный вес ниже 1010 единиц, то налицо изостенурия, характерная для очень тяжелого поражения почек, включая нейросклероз.
Подробнее ознакомиться со всеми основными показателями мочи и их расшифровкой можете в этой таблице.
Органические вещества в моче
Латинское ее обозначение в анализе - glu (glucose). Самый желанный результат исследования на сахар - показатель его отсутствия: glu negative или glu neg. Но, если он обнаруживается, врачи констатируют глюкозурию. Чаще всего это удел диабетиков.
Однако она может быть не только панкреатической, но и почечной, печеночной, если поражены эти органы. Симптоматическая глюкозурия отмечается при травмах и заболеваниях головного мозга, инсульте, опухоли надпочечников, гипертиреозе и др.
Если в моче обнаружен белок
В анализе он фигурирует под обозначением pro, расшифровка которого проста: протеин, то есть белок. Его концентрация более 0,03 г называется протеинурией. Если суточная потеря белка до 1 г, то это умеренная протеинурия, от 1 г до 3 г - средняя, а больше 3 г - выраженная.
Особый показатель для диабетиков - МАУ. Для них эндокринологи и нефрологи определили «пограничную зону»: микроальбуминурию или МАУ. Микроальбумины - самые маленькие экземпляры белков, которые попадают в мочу в первую очередь. Поэтому показатель МАУ - самый ранний маркер почечных нарушений при сахарном диабете. Суточная норма таких минибелков до 3,0-4,25 ммоль.
МАУ - очень важный параметр, по которому можно судить об обратимости поражения почек. Ведь диабетическая нефропатия одна из главных причин инвалидности и смертности при диабете. Коварность этого тяжелого осложнения в том, что оно развивается медленно, незаметно и не вызывает болезненных симптомов.
Контроль мочи позволяет вовремя выявлять уровень МАУ и назначать соответствующую терапию для восстановления почек.
Метод определения МАУ - наиболее эффективный, так как измерить концентрацию альбуминов другими лабораторными способами весьма затруднительно.
Билирубин, желчные кислоты, индикан. Норма - когда в анализе значится: bil neg (bilirubin negative), то есть билирубина нет. Его наличие сигнализирует о патологиях печени или желчного пузыря. Если концентрация билирубина в крови превышает 17-34 ммоль/л, то в моче появляются желчные кислоты. Обычно это тоже следствие патологий печени и желчного пузыря.
Уробилиноген, кетоновые тела. Положительный показатель ubg означает наличие уробилиногена. Он может сигнализировать о болезнях печени или крови, инфаркте миокарда, инфекциях, энтероколите, камнях в желчном пузыре, завороте кишок, других патологиях. Суточная концентрация ubg при этом выше 10 мкмоль.
Наличие в моче кетоновых тел - ket, содержащих ацетон и его производные, бывает следствием длительного наркоза, голодания, сахарного диабета, тиреотоксикоза, инсульта, отравлений угарным газом или свинцом, передозировкой некоторых препаратов.
О чем свидетельствует показатель asc? Он указывает, сколько аскорбиновой кислоты выделяется с мочой. Нормой для здорового организма считается около 30 мг в сутки. Выявлять уровень asc бывает необходимо у младенцев на искусственном вскармливании, онкобольных, курильщиков, алкоголиков, при ожогах, депрессиях, подозрениях на авитаминоз, цингу, камни в почках, инфекционные заболевания.
Кроме того, до проведения анализов на глюкозу, гемоглобин, билирубин или нитриты целесообразно определить концентрацию asc. Ведь если она превышает 0,3 ммоль/л, общий анализ мочи может выдать недостоверные результаты.
Микроскопический анализ мочевого осадка
Лейкоциты, эритроциты. Количество лейкоцитов - leu - в мочевом осадке у здоровых людей не должно превышать 0-3 для мужчин и 0-5 для женщин. Отклонение от нормы - явный признак воспалительных процессов, прежде всего в мочеполовой системе.
Эти воспаления, а также злокачественные опухоли приводят к появлению в моче эритроцитов - bld. Их количество позволяет судить о том, как развивается заболевание и насколько эффективно лечение. У женщин в первое время после родов высок уровень эритроцитов, но это считается нормальным явлением.
Цилиндры, эпителиальные клетки, креатинин. В мочевом осадке всегда должны отсутствовать цилиндры всех видов, кроме гиалиновых. Наличие остальных разновидностей обычно связано с поражением почек, гипертонией, вирусными инфекциями, тромбозами, химическим отравлением, приемом ряда антибиотиков.
Наличие 3 эпителиальных клеток - vtc - предельно допустимое количество. Повышенное содержание клеток плоского эпителия наблюдается при уретритах; переходного - при пиелите, пиелонефрите, цистите; почечного - при серьезном поражении почек. Высокий показатель vtc чаще всего свидетельствует о тяжелом нефрите или нефрозе.
Норма креатинина - cre - составляет 0,64-1,6 г/л для мужчин и 0,48-1,44 г/л для женщин. Пониженное его содержание в моче и одновременно высокий уровень в крови характерны для патологий почек. Анализы на креатин требуются при эндокринных заболеваниях, мышечной дистрофии, беременности.
Минералы, слизь, бактерии, хлопья. Соли в небольших количествах - вариант нормы. Но если это кристаллы или соли мочевой кислоты uro, то при их обнаружении можно предположить развитие подагры, гломерулонефрита, застойной почки либо лейкоза. Оксалаты нередко выявляются при пиелонефрите, диабете, эпилепсии, фосфаты - при цистите, камнях в мочевом пузыре.
Слизи в моче быть не должно. Она обычно появляется, когда хронически больны органы мочеполовой сферы. Это и камни в мочевом пузыре, и цистит, и уретрит, и аденома простаты.
Бактерии - nit (нитриты) - фиксируются в осадке, если в мочевыделительных органах развиваются острые инфекции. При этом могут обнаруживаться и хлопья. Это в основном тоже nit - погибшие бактерии, а также отмершие клетки эпителия.
Как мы видим, общий анализ мочи, расшифровка содержащихся в нем веществ, весьма информативен. Конечно, только его результаты, даже самые точные, еще не позволяют установить конкретное заболевание. Но вместе с данными других видов исследования с учетом клинических симптомов пациента, общий анализ мочи и сегодня важный диагностический инструмент.
101analiz.ru
Диабетическая нефропатия или как сохранить почки при диабете
Диабетическая нефропатия - одно из многочисленных осложнений сахарного диабета, которые я перечисляла в статье «Осложнения сахарного диабета не зависят от типа». Насколько опасна диабетическая нефропатия? На этот и другие вопросы вы узнаете ответы, прочитав статью до конца. Доброго всем времени суток!
Как я уже неоднократно говорила, самое опасное - не сам факт диабета, а его осложнения, потому что именно они приводят к инвалидности и ранней смерти. Я также говорила в своих предыдущих статьях, и не устану повторять, что тяжесть и скорость развития осложнений полностью зависят от самого пациента или от ухаживающего родственника, если это ребенок. Хорошо скомпенсированный сахарный диабет - это когда уровень сахара крови натощак не превышает 6,0 ммоль/л, а через 2 часа не выше 7,8 ммоль/л, и при этом разница колебаний уровня глюкозы в течение суток не должна превышать 5 ммоль/л. В этом случае развитие осложнений откладывается на долгий срок, а вы наслаждаетесь жизнью и не имеете проблем.
Но не всегда удается скомпенсировать заболевание, и осложнения не заставляют себя ждать. Одним из органов-мишеней при сахарном диабете являются почки. Ведь организм избавляется от лишней глюкозы путем выведения ее через почки с мочой. Кстати, еще в древнем Египте и древней Греции врачи ставили диагноз, пробуя на вкус мочу больного человека, при диабете она имела сладкий вкус.
Существует определенный предел повышения уровня глюкозы в крови (почечный порог), доходя до которого в моче начинает определяться сахар. У каждого человека это порог индивидуален, но в среднем эта цифра считается 9 ммоль/л. Когда переваливает за этот уровень, почки не в состоянии всасывать глюкозу обратно, потому что ее становится очень много и она появляется во вторичной моче человека. К слову скажу, что почки сначала образовывают первичную мочу, количество которой в несколько раз больше той, что выделяет человек в сутки. Через сложную систему канальцев,часть этой первичной мочи, в которой находится глюкоза (в норме), всасывается обратно (вместе с глюкозой), и остается та часть, которую вы видите каждый день в туалете.
Когда глюкозы слишком много, то почки так и всасывают столько сколько нужно, а избыток выводится. При этом избыток глюкозы тянет за собой воду, поэтому пациенты с сахарным диабетом много выделяют много мочи по сравнению со здоровым человеком. Но повышенное мочеиспускание характерно для некомпенсированного диабета. Те, кто держит свой уровень сахара в норме, выделяют мочи столько же, сколько и здоровый человек, если, конечно, нет какой-нибудь сопутствующей патологии.
Как я уже упомянула, почечный порог у каждого свой, но в общем приходится на 9 ммоль/л. Если почечный порог снижается, т. е. сахар в крови появляется уже при более низких значениях, то это означает, что имеются серьезные проблемы с почками. Как правило, снижение почечного порога для глюкозы характерно для почечной недостаточности.
Избыток глюкозы в моче оказывает токсическое действие на почечные канальцы, приводя к их склерозу. Кроме этого, возникает внутриклубочковая гипертензия, а также артериальная гипертензия, которая часто встречается при СД 2 типа, тоже оказывает свое отрицательное влияние. Все вместе эти факторы приводят к неминуемой почечной недостаточности, которая требует пересадки почки.
Стадии развития диабетической нефропатии (ДН)
В нашей стране принята следующая классификация диабетической нефропатии:
- Диабетическая нефропатия, стадия микроальбуминурии.
- Диабетическая нефропатия, стадия протеинурии с сохраненной фильтрационной функцией почек.
- Диабетическая нефропатия, стадия хронической почечной недостаточности.
Но во всем мире принята несколько иная классификация, которая включает в себя доклиническую стадию, т. е. самые ранние нарушения в почках. Вот эта классификация с объяснением каждой стадии:
- Гиперфункция почек (гиперфильтрация, гиперперфузия, гипертрофия почек, нормоальбуминурия до 30 мг/сут).
- Начинающаяся ДН (микроальбуминурия 30-300 мг/сут, нормальная или умеренно повышенная скорость клубочковой фильтрации).
- Выраженная ДН (протеинурия, т. е. сахар виден в обычном общем анализе мочи, артериальная гипертензия, снижение скорости клубочковой фильтрации, склероз 50-75 % клубочков).
- Уремия или почечная недостаточность (снижение скорости клубочковой фильтрации менее 10 мл/мин., тотальный гломерулосклероз).
Немногие знают, что на самом начальном этапе развития осложнение еще обратимо, даже на стадии микроальбуминурии можно вернуть время вспять, но если обнаружилась стадия протеинурии, то процесс необратим. Единственное, что можно сделать, так это остановить на данном этапе, чтобы не было прогрессирования осложнения.
А что нужно делать, чтобы обратить изменения и остановить прогрессирование? Правильно, нужно нормализовать уровень сахара прежде всего, и еще кое-что, о чем я буду говорить в абзаце про лечение ДН.
Диагностика диабетической нефропатии
На начальном этапе данное осложнение не имеет клинических проявлений, а поэтому не замечается самим пациентом. Когда имеется массивная потеря белка (протеинурия), могут возникнуть безбелковые отеки, повышение артериального давления. Я думаю, что стало понятно, почему нужно регулярно следить за функцией почек.
В качестве скрининга всем пациентам назначается анализ мочи на микроальбуминурию (МАУ). Не путайте данный анализ с общим анализом мочи, этот метод не способен выявить «маленькие» белки, которые в первую очередь проскакивают через базальную мембрану клубочков. Когда в общем анализе мочи появляется белок, то это значит, что происходит потеря «крупных» белков (альбуминов) и базальная мембрана уже похожа на решето с крупными дырками.
Итак, тест на МАУ можно делать дома и в лаборатории. Чтобы измерить в домашних условиях нужно приобрести специальные тест-полоски «Микраль-тест», подобные тест-полоскам для определения в моче уровня сахара и кетоновых тел. По изменению цвета тест-полоски вы узнаете о количестве микроальбумина в моче.
Если вы обнаружили микроальбуминурию, то рекомендуется пересдать анализ в лаборатории, чтобы выявить конкретные цифры. Обычно сдают суточную мочу на МАУ, но в некоторых рекомендациях пишут, что достаточно сдать утреннюю порцию мочи. Микроальбуминурией считается обнаружение белка в диапазоне 30-300 мг/сут., если собиралась суточная моча, и выявление в утренней порции мочи белка в диапазоне 20-200 мг/л свидетельствует о МАУ. Но однократное обнаружение микроальбумина в моче вовсе не значит, что начинается ДН.
Повышение белка в моче может быть и при других состояниях, не связанных с сахарным диабетом, например:
- при большом употреблении белка
- после тяжелой физической нагрузки
- на фоне высокой температуры
- на фоне мочевой инфекции
- при беременности
Кому и когда показано проведение анализа на МАУ
Исследование мочи на микроальбуминурию проводят, когда еще не обнаруживается белок в общем анализе мочи, т. е. когда нет явной протеинурии. Анализ назначается в следующих случаях:
- Всем пациентам с СД 1 типа старше 18 лет, начиная с 5-го года после дебюта заболевания. Проводится 1 раз в год.
- Детям с СД 1 типа вне зависимости от длительности заболевания. Проводится 1 раз в год.
- Всем пациентам с СД 2 типа вне зависимости от длительности заболевания. Проводится 1 раз в 6 месяцев.
При выявлении микроальбуминурии сначала следует удостовериться, что на анализ не повлияли факторы, о которых шла речь выше. При выявлении микроальбуминурии у пациентов с длительностью сахарного диабета более 5-10 лет диагноз диабетической нефропатии, как правило, не вызывает сомнений, если, конечно, нет других заболеваний почек.
Что дальше
Если микропротеинурия не выявлена, то вы ничего не предпринимаете, кроме того, что по-прежнему следите за уровнем глюкозы в крови. Если же микроальбуминурия подтвердилась, то наравне с рекомендациями о компенсации нужно начинать определенное лечение, о чем я скажу чуть позже.
Если же у вас обнаруживается уже протеинурия, т. е. появляется белок в общем анализе мочи, то анализ рекомендуется повторить еще 2 раза. В случае сохранения протеинурии необходимо дальнейшее исследование функции почек. Для этого исследуются креатинин крови, скорость клубочковой фильтрации, уровень артериального давления. Проба, определяющая фильтрационную функцию почек, называется пробой Реберга.
Как сдается проба Реберга?
Собирается суточная моча (в 6:00 ночная моча сливается в унитаз, на протяжении всего дня и ночи до 6:00 следующего утра моча собирается в отдельную емкость; подсчитывается количество собранной мочи, она перемешивается и отливается около 100 мл в отдельную баночку, которая относится в лабораторию). В лаборатории вы сдаете кровь из вены и сообщаете количество мочи за сутки.
Снижение скорости клубочковой фильтрации говорит о прогрессировании ДН и скором развитии почечной недостаточности. Повышение скорости клубочковой фильтрации говорит о начальных изменениях в почках, которые могут быть обратимы. После всего обследования по показаниям проводится лечение.
Но должна сказать, что пробу Реберга сейчас мало используют, а на ее место пришли другие более точные формулы для расчета, например, формула MDRD. Для детей используется формула Шварца. Ниже я привожу картинку на которой изображены самые современные формулы для расчета СКФ.

Считается, что формула MDRD наиболее точнее, чем формула Кокрофта-Голта. Нормальными значениями СКФ считается в среднем 80-120 мл/мин. Показания СКФ ниже 60 мл/мин свидетельствуют о почечной недостаточности, когда начинают увеличиваться показатели креатинина и мочевины крови. В интернете имеются сервисы, где вы можете рассчитать СКФ, просто подставив свои значения, например, на этом сервисе.
Можно ли еще раньше обнаружить «заинтересованность» почек
Да, можно. В самом начале я говорила, что имеются отчетливые признаки самых первых изменений в почках, которые можно подтвердить лабораторно и о которых часто забывают врачи. Гиперфильтрация может указывать, что в почке начинается патологический процесс. Гиперфильтрация, т. е. скорость клубочковой фильтрации, ее еще называют клиренсом креатинина, всегда присутствует на начальном этапе диабетической нефропатии.
Повышение СКФ более 120 мл/мин может указывать на проявление данного осложнения, но не всегда. Следует учитывать, что скорость фильтрации может увеличиваться от физической активности, чрезмерного потребления жидкости и пр. Поэтому лучше пересдать анализы еще раз через некоторое время.
Лечение диабетической нефропатии
Вот мы и добрались до самого важного в данной статье. Что же делать, когда нефропатия есть. Прежде всего нормализовать уровень глюкозы, потому что если этого не сделать, то лечение будет впустую. Второе, что нужно делать, - это держать под контролем артериальное давление, а если оно в норме, периодически его контролировать. Целевое давление должно быть не более 130/80 мм рт. ст.
Эти два постулата профилактики и лечения ДН рекомендуются в любой стадии заболевания. Далее в зависимости от стадии в рекомендации будут добавляться новые пункты. Итак, при стойкой микропротеинурии рекомендован длительный прием ингибиторов АПФ (эналаприл, периндоприл и другие «прилы»). Ингибиторы АПФ - это антигипертензивные препараты, но в маленьких дозах они не оказывают эффекта снижения давления, но зато у них сохраняется выраженный ангиопротекторный эффект. Препараты из этой группы оказывают положительное действие на внутреннюю стенку сосудов, в том числе и сосудов почек, а потому благодаря им происходит обратное развитие патологических процессов в стенке сосудов.
Другим препаратом, который рекомендуют при диабетической нефропатии, является сулодексид (Вессел Ду Ф). Он также оказывает положительное влияние на микроциркуляторное русло почек. На данной стадии этих препаратов достаточно и ограничений в питании нет.
На стадии хронической почечной недостаточности проводится коррекция фосфорно-кальциевого обмена, потому что идет потеря кальция с развитием остеопороза, а также коррекция анемии препаратами железа. В терминальной стадии таким пациентам проводят гемодиализ или же трансплантацию почки.
На этом у меня все. Берегите себя и свои почки. Подписывайтесь на обновления блога и будьте в курсе.
saxarvnorme.ru
Клиническое значение микроальбуминурии в практике врача. - ООО "МЕД-М" эксклюзивный дистрибьютор HemoCue в России.
Учреждение Российской академии медицинских наук Российский научный центр хирургии имени академика Б.В. Петровского РАМН
Морозов Ю.А., Дементьева И.И., Чарная М.А.
Пособие для врачей
В пособие рассмотрены вопросы патогенеза и клиническое значение микроальбуминурии. Большое внимание уделено современной лабораторной диагностики протеинурии/микроальбуминурии, а также мониторингу этого состояния в процессе течения заболевания и его терапии. Показано важное клиническое значение микроальбуминурии как показателя прогрессирования таких патологий как сахарный диабет, артериальная гипертензия. Приведены способы коррекции почечных нарушений, сопровождающихся микроальбуминурией. Пособие предназначено для врачей любых специальностей, студентов, ординаторов и аспирантов медицинских вузов, а также для преподавателей и слушателей Школы диабета и Школы гипертоника.
Морозов Ю.А., Дементьева И.И., Чарная М.А., 2010
Здоровый взрослый человек сутки выделяет до 150 мг белка, причем только 10-15 мг приходится на альбумин. Остальное количество представлено 30 разными белками плазмы и гликопротеинами – продуктами деятельности почечных клеток. Среди белков, содержащихся в моче, превалирует мукопротеин Тамма-Хорсфалля. Его происхождение связано не с плазмой, а с клетками восходящего колена петли Генле. Скорость его экскреции составляет 25 мг/сут. При отсутствии инфекции мочевыводящих путей и острого заболевания повышенная экскреция альбуминов с мочой, как правило, отражает патологию клубочкового аппарата почек. Под термином «микроальбуминурия» (МАУ) понимают экскрецию альбумина с мочой в количестве, превышающем физиологическую норму, но ниже пределов чувствительности обычно используемых методов (табл. 1) . Таблица 1. Определение МАУ
Скорость экскреции альбуминов с мочой 30-300 мг/24 ч Скорость экскреции альбуминов с мочой 20-200 мг/мин Содержание альбуминов в ранней утренней порции мочи 30-300 мг/л Отношение альбумины/креатинин 30-300 мг/г (в США)
Отношение альбумины/креатинин 2,5-25 мг/ммоль* (в странах Европы
Примечание: У женщин нижний предел отношения альбумины/креатинин составляет 3,5 мг/ммоль.
В норме низкомолекулярные белки плазмы легко фильтруются в почечных клубочках. Эндотелиальные клетки клубочковых капилляров образуют барьер с порами диаметром около 100 нм. Базальная мембрана препятствует прохождению молекул с относительным молекулярным весом более 100.000 Д . Также поверхность базальной мембраны клубочка, контактирующей с мочой, покрыта отростками висцеральных клеток эпителия – подоцитов. Их отростки образуют многочисленные узкие канальцы, выстланные отрицательно заряженными гликопротеинами. Альбумин в целом тоже заряжен отрицательно, что затрудняет его фильтрацию.
Реабсорбция белка происходит с помощью пиноцитоза. Пиноцитозные вакуоли отшнуровываются и движутся в сторону базальной части клетки, в околоядерную области, где находится аппарат Гольджи. Они могут сливаться с лизосомами, где происходит гидролиз. Образующиеся аминокислоты выделяются через базальную плазматическую мембрану в кровь. В клетках канальцев имеются специфические механизмы для раздельной реабсорбции различных белков – альбумина, гемоглобина [Чиж А.С., 1983.].
При болезнях почечных клубочков могут разрушаться эти фильтрационные барьеры. Поражение, ограниченное только полианионными гликопротеинами, сопровождается избирательной потерей с мочой отрицательно заряженных белков (альбумина). Более обширное повреждение, распространяющееся на всю базальную мембрану, ведет к потере наряду с альбумином и крупных по размерам белков.
В основе нарушения работы клубочкового фильтра лежат различные патогенетические механизмы:
- токсические или воспалительные изменения гломерулярной базальной мембраны (отложение иммунных комплексов, фибрина, клеточная инфильтрация), вызывающие структурную дезорганизацию фильтра;
- изменения гломерулярного кровотока (вазоактивные агенты – ренин, ангиотензин II, катехоламины), влияющие на гломерулярное транскапиллярное давление, процессы конвекции и диффузии;
- недостаток (дефицит) специфических гломерулярных гликопротеидов и протеогликанов, ведущий к потере фильтром отрицательного заряда.
Канальцевая протеинурия связана либо с неспособностью канальцев реабсорбировать белки, прошедшие через неизмененный гломерулярный фильтр, либо обусловлена выделением белка эпителием самих канальцев. Она наблюдается при остром и хроническом пиелонефрите, отравлении тяжелыми металлами, остром канальцевом некрозе, интерстициальном нефрите, хроническом отторжении почечного трансплантата, калийпенической нефропатии, генетических тубулопатиях.
Под селективностью протеинурии понимают способность клубочкового фильтра почек пропускать молекулы белков плазмы в зависимости от их молекулярной массы. Селективность протеинурии уменьшается по мере нарастания проницаемости клубочкового фильтра в результате его повреждения. Появление в моче крупномолекулярных белков (α2- и γ-глобулинов) свидетельствует о неселективной протеинурии и глубоких повреждениях клубочкового фильтра почек. Напротив, экскреция с мочой низкомолекулярных альбуминов указывает на незначительное повреждение базальных мембран клубочковых капилляров и на высокую селективность протеинурии. Таким образом, селективность протеинурии может служить показателем степени повреждения клубочкового фильтра и, следовательно, имеет важное диагностическое и прогностическое значение. Установлено, например, что наиболее высокая селективность протеинурии наблюдается при «минимальных изменениях» в клубочках, тогда как при более глубоких повреждениях структуры клубочковых капилляров (при мембранозном и особенно пролиферативном гломерулонефрите) селективность протеинурии снижается.
В зависимости от степени выраженности выделяют легкую, умеренную и тяжелую протеинурию . Легкая протеинурия (от 300 мг до 1 г/сут) может наблюдаться при острой инфекции мочевыводящих путей, обструктивной уропатии и пузырно-мочеточниковом рефлюксе, тубулопатиях, мочекаменной болезни, хроническом интерстициальном нефрите, опухоли почки, поликистозе. Умеренная протеинурия (от 1 до 3 г/сут) отмечается при остром канальцевом некрозе, гепаторенальном синдроме, первичном и вторичном гломерулонефрите (без нефротического синдрома), протеинурической стадии амилоидоза. Под тяжелой, или выраженной протеинурией понимают потерю белка с мочой, превышающую 3,0 г в сутки или 0,1 г и более на килограмм массы тела за 24 часа. Такая протеинурия почти всегда связана с нарушением функции клубочкового фильтрационного барьера в отношении размера или заряда белков и наблюдается при нефротическом синдроме.
У практически здоровых людей под воздействием различных факторов может появляться преходящая (физиологическая, функциональная) протеинурия. Физиологическая протеинурия, как правило, незначительная – не более 1,0 г/сут.
Преходящее выделение белка с мочой у здоровых людей может появляться после тяжелой физической нагрузки (длительные походы, марафонский бег, игровые виды спорта). Это так называемая рабочая (маршевая) протеинурия или протеинурия напряжения. Генез такой протеинурии объясняют гемолизом с гемоглобинурией и стрессовой секрецией катехоламинов с преходящим нарушением гломерулярного кровотока. При этом протеинурия выявляется в первой после физической нагрузки порции мочи.
Значение фактора охлаждения в генезе преходящей протеинурии было отмечено у здоровых людей под влиянием холодных ванн. При выраженной реакции кожи на инсоляцию развивается albuminuria solarus . Описана протеинурия при раздражении кожи некоторыми веществами, например, йодом. Установлена возможность появления протеинурии при повышении уровня адреналина и норадреналина в крови, чем объясняют выделение белка с мочой при феохромоцитоме и гипертонических кризах. Выделяют алиментарную протеинурию, появляющуюся иногда после употребления обильной белковой пищи. Доказана возможность появления центрогенной протеинурии – при эпилепсии, сотрясении мозга. Эмоциональная протеинурия возникает во время экзаменов [Чиж А.С., 1974.].
К протеинурии функционального происхождения относят и описываемое некоторыми авторами выделение белка с мочой при энергичной и продолжительной пальпации живота и области почек (пальпаторная протеинурия).
У новорожденных в первые недели жизни также наблюдается физиологическая протеинурия.
Лихорадочная протеинурия наблюдается при острых лихорадочных состояниях, чаще у детей и стариков. Протеинурия сохраняется в период повышения температуры тела и исчезает при ее снижении и нормализации. Если протеинурия сохраняется в течение многих дней и недель после нормализации температуры тела, то следует исключить возможное органическое заболевание почек. При заболеваниях сердца часто выявляют застойную, или сердечную протеинурию. С исчезновением сердечной недостаточности она обычно исчезает.
Ортостатическая (постуральная, лордотическая) протеинурия наблюдается у 12 – 40% детей и подростков, характеризуется выявлением белка в моче при длительном стоянии или ходьбе с быстрым исчезновением (преходящий вариант ортостатической протеинурии) или уменьшением его (персистирующий вариант) в горизонтальном положении. Генез ее связывают с нарушениями почечной гемодинамики, развивающимися за счет лордоза, сдавливающего нижнюю полую вену в положении стоя, или выброса ренина (ангиотензина II) в ответ на изменения объема циркулирующей плазмы при ортостазе.
Ярошевский А.Я. (1971) выделил три основных типа патологической протеинурии. К ренальной протеинурии относят:
Протеинурию, связанную с выделением нормальных сывороточных белков через поврежденный клубочковый фильтр; - тубулярную протеинурию, обусловленную выделением белка эпителием канальцев; - протеинурию, связанную с недостаточностью реабсорбции белков при поражении канальцев.
Протеинурия может иметь внепочечный характер, возникает при отсутствии патологического процесса в самих почках и делится на преренальную и постренальную
Преренальная протеинурия развивается при наличии необычно высокой плазматической концентрации низкомолекулярного белка, который фильтруется нормальными клубочками в количестве, превышающем физиологическую способность канальцев к реабсорбции. Подобный тип протеинурии наблюдается при миеломной болезни (в крови появляется низкомолекулярный белок Бенс-Джонса и другие парапротеины), при выраженном гемолизе (за счет гемоглобина), рабдомиолизе, миопатии (за счет миоглобина), моноцитарном лейкозе (за счет лизоцима).
Постренальная протеинурия обусловлена выделением с мочой слизи и белкового экссудата при воспалении мочевых путей или кровотечением. Заболевания, которые могут сопровождаться внепочечной протеинурией - мочекаменная болезнь, туберкулез почки, опухоли почки или мочевых путей, циститы, пиелиты, простатиты, уретриты, вульвовагиниты. Постренальная протеинурия чаще весьма незначительна и практически менее важна.
Экскреция альбуминов с мочой колеблется в течение суток в широких пределах. В ночное время она на 30-50% меньше, чем в дневное время, что связано с тем, что ночью в горизонтальном положении ниже уровни системного артериального давления, почечного плазмотока и скорости клубочковой фильтрации. Уровень выделения альбуминов значительно возрастает в вертикальном положении и после физической нагрузки, при повышенном потреблении белков с пищей . Высокое выведение альбуминов с мочой чаще встречается у лиц пожилого возраста, лиц негроидной расы. У курильщиков экскреция альбуминов с мочой выше, чему некурящих .
Распространенность МАУ в общей популяции колеблется от 5 до 15% . Частота обнаружения МАУ практически не зависит от используемых критериев и пола обследованных лиц (табл. 2). В то же время наблюдается тесная связь между частотой обнаружения МАУ и курением, индексом массы тела, уровнем артериального давления (АД) и уровнем холестеринемии. Особенно часто МАУ обнаруживается при сахарном диабете и артериальной гипертензии. По данным различных исследователей, МАУ встречается у 10-40% больных сахарным диабетом I типа и 15-40% больных сахарным диабетом II типа .
Таблица 2. Частота обнаружения МАУ
В большинстве лабораторий при исследовании мочи «на белок» сначала пользуются качественными реакциями, которые не обнаруживают белок в моче здорового человека. Если же белок в моче обнаружен качественными реакциями, проводят количественное (полуколичественное) его определение. При этом имеют значение особенности используемых методов, охватывающих различный спектр уропротеинов. Так, при определении белка с помощью 3% сульфосалициловой кислоты, нормальным считается количество белка до 0,03 г/л, при использовании же пирогаллолового метода, граница нормальных значений белка повышается до 0,1 г/л. В связи с этим в бланке анализа указывается нормальное значение белка для того метода, которым пользуется лаборатория.
Для количественного определения уровня экскреции альбуминов с мочой в настоящее время используются радиоиммунные, иммуноферментные и иммунотурбидиметрические методы. Обычно содержание альбуминов определяют в моче, собранной за 24 часа, хотя удобнее использовать для этой цели либо первую утреннюю порцию мочи, либо мочу, собранную утром за 4 часа, либо мочу, собранную за ночное время (за 8-12 часов). Если содержание альбуминов определяется в первой утренней порции или в порции мочи, собранной в ночное время, то уровень экскреции альбуминов с мочой выражают в мг на 1 л мочи [Чиж А.С. и соавт., 1992.]. Зачастую трудно бывает точно измерить время, в течение которого собиралась моча; в таких случаях рекомендуется определять отношение альбуминов к креатинину в моче, в особенности в первой утренней порции. В норме отношение альбумины/креатинин составляет менее 30 мг/г или менее 2,5-3,5 мг/моль.
Метод радиальной иммунодиффузии является наиболее простым, доступным и относительно недорогим методом. Широкого распространения этот метод не получил, так как требует длительного инкубационного периода и высокой квалификации персонала.
Радиоиммунный метод является высокочувствительным. В связи с тем, что реактивы имеют ограниченный срок годности в связи с относительно коротким периодом полураспада изотопа йода, метод в настоящее время используется достаточно редко.
При проведении иммуноферментного анализа используют различные варианты этого метода, отличающиеся по материалу твердой фазы, способам крепления к ней антител, последовательностью добавления реагентов, вариантами отмывки твердой фазы, источником фермента в конъюгате, типом субстрата, способом выражения результатов анализа. Вместо антиальбуминовых антител разработан метод с использованием альбуминового рецептора, полученного генно-инженерным методом [Гупалова Т.В., Пологнюк В.В., 1997.].
Иммунотурбидиметрия является более простым по сравнению с радиоиммунным методом. Определение может быть проведено как в кинетическом, так и в равновесном варианте.
В настоящее время фирмой HemoCue (Швеция) разработан и внедрен на российский рынок анализатор альбумина HemoCue Albumin 201. Это портативный фотометр, предназначенный для определения МАУ с возможностью работы как от блока батареек, так и от электросети. Диапазон измерения составляет 5-150 мг/л. Время получения результата – около 90 сек.
Анализатор может быть использован для количественного определения МАУ с целью скрининга, диагностики, мониторинга и контроля лечения. HemoCue Альбумин 201 система основана на иммунотурбидиметрической реакции с использованием антител к человеческому альбумину. Комплекс антиген-антитело изменяет светопропускание кюветы, что измеряется фотометрически при длине волны 610 нм. Концентрация альбумина пропорциональна мутности и результат отображается на дисплее в мг/л. Система состоит из небольшого, специально предназначенного анализатора и в микрокювет в индивидуальной упаковке, содержащих лиофилизированный реагент. Все, что необходимо для получения количественного результата: заполнить микрокювету, поместить ее в анализатор и прочитать результат.
Испытания, проведенные на базе Российско-Швейцарской клинико-диагностической лаборатории «Юнимед Лабораториз» (Москва), аккредитованной в качестве экспертной Минздрава России (рег. 42-5-005-02 от 11.03.2002) показали высокую достоверность результатов, удобство в использовании, что позволяет рекомендовать портативные анализаторы HemoCue для использования в лечебных учреждениях различного уровня (лаборатории больниц, поликлиник, машин скорой помощи, МЧС и непосредственно в отделениях различного профиля). Сравнение результатов определения МАУ с помощью HemoCue Albumin 201 и анализатора Hitachi 917 показало их высокую корреляцию (r2=0.971, r=0.983)/
- Анализатор отличает в эксплуатации. Для определения МАУ необходимо: Заполнить микрокювету мочой, погружая ее наконечника в пробу.
- Вставить заполненную микрокювету в держатель анализатора.
- Через 90 секунд прочитать полученный результат.
Химические турбидиметрические методы основаны на преципитации белка различными агентами, например, сульфосалициловой кислотой, трихлоруксусной кислотой, бензетония хлоридом. В основе всех турбидиметрических методов лежит измерение изменения светопропускания реакционной смеси, обусловленное рассеянием света при образовании мутности. Чем больше концентрация белка в моче, тем большее количество конгломератов образуется. Эти методы плохо поддаются стандартизации, часто приводят к получению ошибочных результатов, но, несмотря на это, в настоящее время они широко используются в лабораториях из-за невысокой стоимости и доступности реактивов. Основные факторы, приводящие к получению некорректных результатов :
- Большое стандартное отношение мочи к реагенту, составляющее, например, для сульфосалициловой кислоты 1:3, что приводит к влиянию различных компонентов мочи на результат анализа;
- Интерференция многих лекарственных препаратов, что сопровождается получением «ложноположительных» или «ложноотрицательных» результатов.
- Замеряемое поглощение исследуемой пробы отражает только определенное временное состояние исследуемой пробы, а не истинную концентрацию белка;
- Различие белкового состава мочи и калибратора-альбумина;
- Мутность, образующаяся из альбумина, в 4 раза выше мутности, образующейся из глобулинов;
- Присутствие в моче легких цепей иммуноглобулинов: некоторые пробы остаются полностью растворимыми после преципитации всех остальных форм белков.
К группе колориметрических методов определения белка относятся методы Лоури, биуретовый и методы, основанные на связывании белка с органическими красителями. Метод Лоури обладает высокой чувствительностью: ~ 10 мг/л и широкой линейной областью измерения - до 1 г/л. Но результаты анализа значительно зависят от аминокислотного состава - интенсивность окрашивания различных белков может различаться в 300 и более раз, поэтому метод не нашел широкого применения в практике [Чиж А.С. и соавт., 1992.]. Биуретовый метод практически не зависит от аминокислотного состава белков. Метод мало чувствителен к присутствующим в пробе различным соединениям. Линейная зависимость примерно в 10 раз шире, чем у метода Лоури, а чувствительность - в ~ 10 раз ниже. Из-за низкой чувствительности метод не пригоден для определения низких концентраций белка. Чувствительность метода может быть повышена различными модификациями, одна из которых заключается в осаждении белка и его концентрировании. Биуретовый метод с осаждением и концентрированием белка считается референсным методом для определения белка в моче, но из-за большой трудоемкости анализа для рутинных исследований в клинических лабораториях практически не применяется [Рябов С.И. и соавт., 1979.].
Другой группой тестов для определения белка в моче являются методы, основанные на связывании белка с органическими красителями. Они привлекают к себе внимание благодаря простоте и быстроте исполнения, высокой чувствительности. Их принцип основан на взаимодействии белка с органическим красителем, в результате чего образуется окрашенный комплекс, интенсивность окраски которого пропорциональна концентрации белка в пробе. К недостатками следует отнести различия в способности разных белков связывать красители. Другим существенным недостатком является нарушение пропорциональной зависимости между концентрацией некоторых белков и оптической плотностью комплекса белок-краситель [Загребельный С.H., Пупкова В.И., 1986, Trivedi V.D. Ital. J., 1997.]. Среди этих тестов можно выделить методы, основанные на связывании белка с кумасси бриллиантовым голубым (КБГ), бромфеноловым синим (БФС) и пирогаллоловым красным (ПГК).
Методы, основанные на связывании белка с КБГ. Данный тип метода был разработан в 1976 году Bradford M.M. Комплекс белок – краситель образуется очень быстро - в течение 2-5 мин с изменением окраски с красной на синюю и остается стабильным в течение часа. Комплекс обладает высокой абсорбцией, что обеспечивает ему высокую чувствительность – 5-15 мг/л. Однако реакция не обеспечивает строгой пропорциональной зависимости между концентрацией белка и поглощением раствора: линейная область определения составляет ~ 500 мг/л. КБГ обладает неодинаковой способностью связывать различные белки. Узкая линейная область измерения и значительная сорбция красителя на стенках кювет ограничивает применение метода в лабораторной практике для рутинных анализов и для адаптации на автоматических анализаторах; тем не менее, ряд фирм производит коммерческие наборы реагентов с применением КБГ для определения белка в моче и спинномозговой жидкости.
Методы, основанные на связывании белка с БФС. Практически одновременно с применением КБГ для определения белка в биологических жидкостях было предложено использовать БФС . Реакция связывания БФС с белками происходит при рН ~ 3 в течение 1 мин, стабильность окраски ~ 8 час. Данный метод имеет меньшую чувствительность, чем КБГ, но и меньшее количество веществ мешают его применению. Чувствительность теста составляет 30-70 мг/л, линейная область определения – до 1 г/л, коэффициент вариации результатов измерения не превышает 5 %. Метод точен, чувствителен, прост и доступен для лабораторной практики. Однако на сегодняшний день применение метода БФС крайне ограничено: ни одна из известных фирм не производит наборы реагентов с использованием БФС и не проводит аттестацию белка в контрольных растворах мочи методом БФС.
Методы, основанные на связывании белка с ПГК. Этот краситель для определения белка в моче был предложен в 1983 году Fujita Y. и соавт. В настоящее время этот метод занял одно из первых мест среди тестов определения белка в моче, постепенно вытесняя все другие. Коммерческие наборы реагентов с использованием ПГК выпускает множество фирм. Оригинальный метод основывается на связывании белка с красителем в кислой среде (рН=2,5). Комплекс устойчив к воздействию многих соединений, в том числе лекарственных препаратов, солей, оснований, кислот. Широкое применение в лабораторной практике метод получил после его модификации Watanabe N. и соавт. (1986). Это позволило расширить линейную область измерения до 2 г/л, которой не обладают методы, использующие другие красители. Воспроизводимость результатов в диапазоне концентраций белка от 0,09 до 4,11 г/л составляет 1-3 %; правильность определения альбумина - 97-102%, глобулина - 69-72 %; чувствительность метода - 30-40 мг/л; стабильность реагента при хранении в защищенном от света месте - 6 мес. Краситель ПГК не сорбируется на стенках кювет до концентрации белка 5 г/л, поэтому метод адаптирован к различным типам анализаторов .
Диагностические полоски позволяют быстро провести полуколичественную оценку содержания белка в моче. Применение прибора, основанного на принципе отражательной фотометрии, позволяет использовать полоски, как для полуколичественной, так и количественной оценки результатов [Козлов А.В., Слепышева В.В., 1999.]. На полосках в качестве индикатора чаще всего используется краситель БФС в цитратном буфере. Однако при исследовании мочи с высоким значением рН емкость буферного раствора может оказаться недостаточной для поддержания рН в реакционной зоне, что приведет к ложноположительному результату. Повышение или понижение относительной плотности мочи также может вызвать изменение чувствительности полосок. Высокое содержание солей в моче снижает результаты. Отрицательные результаты на полосках не исключают присутствия в моче глобулина, гемоглобина, белка Бенс-Джонса, мукопротеина. В связи с этим полоски в большей мере приспособлены к обнаружению селективной клубочковой протеинурии. При оценке неселективной клубочковой протеинурии (а также канальцевой) результаты исследования оказываются ниже ее реального уровня. Еще в меньшей степени полоски приспособлены для обнаружения белков Бенс-Джонса. Применение диагностических полосок следует ограничить скрининговыми процедурами, они удобны для быстрой оценки протеинурии непосредственно у постели больного. Ложноположительные результаты на полосках могут быть также вызваны загрязнением посуды для сбора мочи остатками моющих средств, хлоргексидином, амидоаминами, при лечении феназопиридином, введении поливинилпирролидона [Пупкова В.И., Прасолова Л.М., 2006.].
САХАРНЫЙ ДИАБЕТ
Классическое описание специфических изменений почек при сахарном диабете дано в работе P.Kimmelstiel и C.Wilson (1936), приведшее к появлению термина «диабетический гломерулосклероз». Однако термин не характеризует всего многообразия поражения почек, так что вместо этого стали использовать термин «диабетическая нефропатия». В 1944 году Laipply Т. и соавт. впервые описали утолщение базальных мембран петель клубочков, указав, что похожие изменения обнаруживаются практически в любом органе, имеющем базальную мембрану в сосудах. Этими работами была определена главная составляющая диабетической нефропатии – поражение микрососудистого русла (микроангиопатия).Результаты экспериментальных и клинических исследований свидетельствуют о том, что микроангиопатия носит универсальный характер как проявление поражения клеток рыхлой соединительной ткани, рассматривая этот факт как синдром дефицита поступления в клетки полиненасыщенных жирных кислот.
Такая концепция позволяет констатировать общие патогенетические механизмы при атеросклерозе, гипертонической болезни, сахарном диабете и метаболическом синдроме Х. (Титов В.Н., 2002). Ключевым элементом патогенеза этих состояний является функциональная блокада апо-В-100 рецепторного эндоцитоза липопротеинов низкой плотности (ЛПНП). Клетка, страдающая от дефицита полиеновых жирных кислот, начинает сама синтезировать ненасыщенные жирные кислоты, которые отличаются большей насыщенностью углеродных связей, что приводит к изменению структуры и физико-химических свойств биологических мембран, а также синтезируемых простагландинов, тромбоксанов, простациклинов, лейкотриенов. При дефиците транспорта ω-3-полиеновых жирных кислот клетка начинает синтезировать из ω-9 жирных кислот в основном триеновые структуры. Снижение ненасыщенности ацильных цепей приводит к плотной упаковке аннулярных фосфолипидов, которые группируются в мембране вокруг интегральных белков: рецепторов, ионных каналов, ферментов, сигнальных систем. Это ведет к уменьшению жидкостности микроокружения, нарушению функции интегральных белков и заряда мембран. Снижение числа двойных связей в ацильных остатках фосфолипидов уменьшает отрицательный заряд на поверхности эпителиальных клеток, и альбумин плазмы начинает свободно фильтроваться в первичную мочу в повышенном количестве. При длительной гипергликемии у больных сахарным диабетом глюкоза связывается со многими белками (процесс гликозилирования), необратимо повреждая и белки почечной ткани. Таким образом, при сахарном диабете повреждение нефронов происходит вследствие органического повреждения мембран, наступающих в цепи следующих процессов:
- Гиперфильтрация приводит к отложению белков в мезангии и стимуляции синтеза фибробластами основного вещества соединительной ткани;
- Гликозилирование белков базальной мембраны уменьшает отрицательного заряда и повышает ее проницаемость.
- Стимуляция пролиферации фибробластов и их синтетической активности: усиливает перекисное окисление липидов, что повреждает эндотелий с уменьшением синтеза NO и усилением синтеза эндотелина, приводящее к вазоспазму;
- Усиление синтеза сорбитола и уменьшение синтеза сиаловых кислот усугубляет повреждение тканей;
- Стимуляция ренин-ангиотензиновой системы, особенно при наличии полиморфизма ангиотензинпревращающего фермента (DD генотип), приводит к развитию гипертензии;
- Гиперинсулинемия приводит к пролиферации и гипертрофии гладкомышечных клеток сосудов и мезангиальных клеток с усилением синтеза основного вещества соединительной ткани;
- Усиление функциональной активности тромбоцитов приводит к высвобождению тромбоцитарных факторов роста, иных БАВ, приводящих к микротромбозам;
- Изменение функциональной активности эндотелия, вазоспазм и развитие артериальной гипертензии приводит к необратимым изменениям сосудов и склерозированию тканей.
МАУ может быть единственным проявлением поражения почечного клубочка и является ранним признаком развития нефропатии у больных с сахарным диабетом и артериальной гипертензией. Таким образом, МАУ выявляет нарушение функции плазматических мембран высокодифференцированных клеток вследствие изменения структуры аннулярных фосмфолипидов и заряда мембраны.
Клиническое значение МАУ в том, что она у больных сахарным диабетом является наиболее ранним и достоверным признаком развития диабетической нефропатии. Выявление МАУ у больных инсулинзависимым сахарным диабетом с вероятностью 80% свидетельствует, что в ближайшие 5-7 лет больной «доберется» до клинической стадии диабетической нефропатии и процесс склерозирования клубочков начинает носить необратимый характер [Шулутко Б.И., 2002].
Частота обнаружения МАУ возрастает с увеличением длительности заболевания при сахарном диабете как I типа, так и II типа. Например, в крупном исследовании UK Prospective Diabetes Study (1998) МАУ выявлялась у 12% больных с впервые выявленным сахарным диабетом II типа и почти у 30% больных с длительностью заболевания более 12 лет. По расчетам Parving Н. и соавт. (1996), частота новых случаев МАУ у больных сахарным диабетом колеблется от 1 до 3% в год. У больных сахарным диабетом типа 1 старше 12 лет МАУ иногда обнаруживается через 1 год после развития заболевания. При этом МАУ, как правило, носит интермиттируюший характер и связана с неадекватным гликемическим контролем. Персистирующая МАУ наиболее часто встречается через 10-15 лет после развития СД типа 1. По данным длительных наблюдений, у 80% больных СД типа 1, у которых экскреция альбуминов с мочой составляет 20 мкг/мин (или 29 мг/сут) в течение последующих 10-14 лет развивается диабетическая нефропатия с нарушением функции почек.
Поражение почек при диабете никогда не развивается внезапно (табл. 3). Обычно это достаточно медленный и постепенный процесс, который проходит несколько стадий [Шестакова М.В. и соавт., 2003.].
Таблица 3. Стадии нарушения функции почек при сахарном диабете
На возникновение и прогрессирование МАУ при сахарном диабете могут влиять разнообразные факторы. При повышенном АД экскреция альбуминов с мочой может увеличиваться на 60% в год. Как только экскреция альбуминов с мочой достигает 70-100 мкг/мин, скорость клубочковой фильтрации СКФ начинает снижаться (табл. 4). Таблица 4.
Классификация стадий развития диабетической нефропатии
| Стадия нефропатии | Клинико-лабораторная характеристика | Сроки развития |
| 1. Гиперфункция почек | Увеличение СКФ > 140 мл/мин; - увеличение почечного кровотока; - гипертрофия почек; Нормоальбуминурия ( | |
| 2. Стадия начальных структурных изменений ткани почек | Утолщение базальных мембран и капилляров клубочков; - расширение мезангиума; - сохраняется высокая СКФ; Нормоальбуминурия. | Через 2-5 лет |
| 3. Начинающаяся нефропатия | МАУ от 30 до 300 мг/сут; - СКФ высокая или нормальная; Нестойкое повышение АД; | Через 5-15 лет |
| 4. Выраженная нефропатия | Протеинурия более 500 мг/сут; - СКФ нормальная или умеренно сниженная; Артериальная гипертензия. | Через 10-25 лет |
| Снижение СКФ - симптомы интоксикации. | Через 20 и более лет или через 5-7 лет от появления протеинурии |
При сахарном диабете 2 типа наиболее высокая корреляция выявлена между уровнем МАУ и длительностью заболевания (r= 0,82) . Наиболее высокие показатели МАУ были отмечены у больных сахарным диабетом 2 типа и артериальной гипертензией. При этом, уровень МАУ в одинаковой степени коррелировал с величиной как систолического, так и диастолического АД, в том числе с их суточными индексами [Мазур Е.С., 1999.]. Корреляция с вариабельностью АД при сахарном диабете 2 типа была значительно ниже, чем при артериальной гипертензии без сахарного диабета.
В ряде исследований повышенная экскреция альбуминов с мочой сочеталась с другими микроваскулярными осложнения СД и, в частности, пролиферативной ретинопатией. Это дает основание предполагать, что у некоторых больных СД типа 1 МАУ является ранним проявлением генерализованных поражений микроциркуляторного русла. Уровень МАУ значимо коррелирует с признаками гипертрофии левого желудочка (толщина задней стенки и межжелудочковой перегородки), индексом массы миокарда, а также с проявлением диастолической дисфункции левого желудочка [Минаков Э.В., 2008.]. Это является проявлением доклинической стадии диабетической кардиомиопатии. Примечательно, что с улучшением гликемического контроля не только уменьшается экскреция альбуминов с мочой, но и улучшается диастолическая функция левого желудочка.
Персистирующая МАУ часто сочетается с нарушениями липидного обмена. У пациентов с сахарным диабетом и высоким значением МАУ плазменные уровни общего холестерина, холестерина липопротеидов низкой плотности, триглицеридов и апопротеина В повышены, а уровни холестерина липопротеидов высокой плотности, напротив, ниже, чем у больных с нормальной экскрецией альбуминов с мочой. Кроме того, обнаружены тесные корреляционные связи уровня МАУ с некоторыми биохимическими параметрами, являющимися проявлением повышенного атерогенного потенциала сыворотки крови (общий холестерин, триглицериды, фибриноген, растворимые фибрин-мономерные комплексы) а также с индексом массы тела, что позволяет рассматривать МАУ как составляющую метаболического синдрома [Кобалава Ж.Д., 2002.].
АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
В развитых странах мира, в первую очередь, благодаря широкому использованию эффективных антигипертензивных препаратов, удалось добиться снижения частоты сердечно-сосудистых осложнений АГ. В то же время, в последние годы наблюдается неуклонный рост развития терминальной стадии почечной недостаточности у больных АГ и гипертензия является при этом главной или одной из главных причин у 10-30% больных, находящихся на программном диализе [Преображенский Д. В., Сидоренко Б. А., 1998.].Известно, что почки играют важную роль в регуляции системного кровообращения. Неизмененная почка отвечает на ежедневные колебания АД адекватно и стабилизирующе. Защита от гиперперфузии осуществляется путем повышения тонуса афферентных артериол клубочков. По мере увеличения длительности и частоты эпизодов повышенного АД нарастают структурные изменения стенки почечных сосудов, что приводит к повышению сопротивления избыточному кровотоку [Гогин Е.Е., 1997.]. Морфологически в артериолах и междольковых артериях сначала определяется умеренная гипертрофия средней оболочки (медии).
По мере длительности течения нелеченой АГ, гипертрофия медии становится более выраженной и приводит к ригидности артериол. Это способствует увеличению внутриклубочкового давления, уже недостаточно контролируемого реакцией афферентных артериол. Повышенное интраглобулярное давление оказывает повреждающее действие на поверхность эндотелиоцитов вследствие повышенной механической нагрузки и повышения проницаемости базальных мембран капилляров клубочков для липидов и различных белковых компонентов плазмы . В результате нарушаются условия ультрафильтрации, нарастает транскапиллярный градиент и возникает МАУ
Группа исследователей проекта НОРЕ (Heart Outcome Prevention Evaluation, 2008) убедительно показала, что МАУ строго ассоциирована с риском развития клинических проявлений ИБС, смертью и развитием сердечной недостаточности. Риск возникновения инсульта у больного с повышенным АД в отсутствие МАУ составляет 4,9%, присоединение же МАУ увеличивает этот показатель до 7,3%, развитие гипертрофии левого желудочка - с 13,8 до 24%, а ИБС сердца - с 22,4 до 31% [Кобалава Ж. Д., Котовская Ю. В., 2001.].
Важную роль в прогрессировании поражения почек до стадии терминальной почечной недостаточности, как полагают, играет активация внутрипочечной ренин-ангиотензиновой системы. В почках хроническая активация локальной ренин-ангиотензиновой системы приводит к повышенному образованию ангиотензина II, что сопровождается гипертрофией и пролиферацией мезангиальных, интерстициальных и других клеток паренхимы почек, усилением миграции макрофагов/моноцитов и повышенным синтезом коллагена, фибронектина и других компонентов внеклеточного матрикса [Шестакова М. В., 1999.]. Все это ведет к склерозу почечной ткани. По мере прогрессирования склеротических изменений развиваются окклюзия клубочков и атрофия почечных канальцев, а гиперфильтрация, наблюдаемая ранее, сменяется гипофильтрацией [Мареев В. Ю., 2000.]. Это сопровождается повышением уровня креатинина и мочевины в сыворотке крови и появлением клинических симптомов почечной недостаточности.
Результаты недавно проведенных исследований свидетельствуют, что существует наследственная предрасположенность к повышенной экскреции альбуминов с мочой. Fauvel J. P и соавт. (1991) сообщили о повышенном содержании альбуминов в моче у детей с нормальным АД, близкие родственники которых страдали гипертонической болезнью. Указания на АГ в семейном анамнезе значительно чаще встречались у детей с протеинурией/микрогематурией. По другим данным, средняя скорость экскреции альбуминов с мочой у детей с нормальным АД, родители которых страдали гипертонической болезнью, выше, чем у детей с нормальным АД, чьи родители не имели артериальной гипертензии . Следовательно, существует семейная предрасположенность к развитию МАУ, которая, возможно, сочетается с предрасположенностью к метаболическим нарушениям [Преображенский Д. В. и соавт., 2000.].
Существуют два показателя, указывающие на повышенный риск развития гипертонического ангионефросклероза, - клубочковая гиперфильтрация и МАУ [Сидоренко Б. А. и соавт.,2000.]. На сегодняшний день МАУ должна рассматриваться не только как маркер повреждения почек, но и как фактор, определяющий прогноз. Появление протеинурии указывает на значительный деструктивный процесс в почках, при котором около 50-75% клубочков уже склерозированы, а морфологические и функциональные изменения приняли необратимый характер [Шестакова М. В.,1998.].
По различным данным, распространенность МАУ при артериальной гипертензии колеблется в очень широких пределах – от 3% до 72% в зависимости от ее тяжести и наличия сопутствующих заболеваний. По мнению большинства исследователей, у нелеченых больных мягкой и умеренной артериальной гипертензией распространенность МАУ колеблется от 15 до 40%, составляя, в среднем, около 25% [Шальнова С.А. и соавт., 2002.].
Частота обнаружения МАУ выше у больных впервые диагностированной гипертонии и больных, не получающих антигипертензивных препаратов. Выявлена взаимосвязь МАУ и поражения основных органов-мишеней при гипертонической болезни.
Незначительное повышение креатинина сыворотки (115-133 мкмоль/л (1,3-1,5 мг/дл) у мужчин, 107-124мкмоль/л (1,2-1,4 мг/дл) у женщин, скорости клубочковой фильтрации 133 мкмоль/л (1,5 мг/дл) у мужчин, > 124 мкмоль/л (1,4 мг/дл) у женщин, снижение скорости клубочковой фильтрации 300 мг/г) свидетельствуют об очень высоком риске развития сердечно-сосудистых осложнений.
Уже повышенное нормальное АД (130-139 / 85-89 мм рт.ст.) предрасполагает к развитию МАУ: вероятность ее у этой категории пациентов увеличивается в 2,13 раза по сравнению со строго нормотензивными. Увеличение среднего АД на 10 мм рт.ст. повышает риск возникновения МАУ в 1,41 раза, систолического АД - в 1,27 раза, диастолического АД - в 1,29 раза. Именно повышение АД, особенно систолического, является одной из наиболее значимых в популяции детерминант МАУ. У пациентов с артериальной гипертензией, не сочетающейся с инсулинорезистентностью или сахарным диабетом 2 типа, МАУ отражает гипертоническое поражение почек, конечным этапом которого является глобальный диффузный нефроангиосклероз. У больных артериальной гипертензией следует мониторировать динамику МАУ при назначении антигипертензивной терапии. МАУ необходимо оценить после достижения адекватного контроля АД.
Частота обнаружения МАУ у нелеченых больных АГ зависит от массы тела. Mimran А. и Ribstein J. (1993) обнаружили МАУ у 35% не леченых больных с артериальной гипертензией и ожирением, но лишь у 26% пациентов без ожирения. О значительно более низкой частоте МАУ у больных АГ сообщают Pontremoli R. и соавт. (1997). По их данным МАУ встречалась у 6,7% из 787 больных гипертонической болезнью вне зависимости от пола (соответственно, 6,4 и 7,1% у мужчин и женщин). По данным Ritz Е. и соавт. (1994), повышенная экскреция альбуминов с мочой обнаруживалась у 5,8% больных артериальной гипертензией моложе 60 лет и у 12,2% пациентов пожилого возраста (табл. 5).
Таблица 5. Частота обнаружения МАУ у больных артериальной гипертензией в зависимости от возраста и уровня АД
Следовательно, распространенность МАУ у амбулаторных пациентов с артериальной гипертензией среднего возраста, получающих медикаментозную терапию, практически не отличается от таковой в общей популяции. Лишь у нелеченых больных и лиц старше 60 лет наблюдается более высокая частота МАУ, чем в общей популяции [Преображенский Д.В. и соавт., 2000.].
Выявлена значимая корреляция МАУ с систолическим АД, в том числе в зависимости от его уровня (r=0,84), вариабельности (r=0,72), а также с суточным индексом и индексом времени ночного систолического АД. Наиболее высокий уровень МАУ обнаружен у больных АГ, отнесенных к категориям «night-peaker» и «non-dipper», как по уровню систолического, так и диастолического АД. В ряде литературных источниках отмечено, что клинически значимая альбуминурия наблюдается, как правило, при диастолическом АД более 100 мм рт. ст. [Литвин А.В., 2004.].
Динамика МАУ может служить одним из критериев эффективности лечения. При артериальной гипертензии снижение АД при одновременном уменьшении МАУ расценивается как более надежный показатель эффективности терапии, чем снижение этих показателей в отдельности. Достаточно длительное (60 недель) поддержание АД на целевом уровне (
ЛЕЧЕНИЕ МИКРОАЛЬБУМИНУРИИ
Понимание патогенеза развития и прогрессирования поражения почек при артериальной гипертензии и/или сахарном диабете, позволяет получить основу для сроков начала терапии МАУ и определить группы препаратов, эффективных для ее устранения, либо замедления прогрессирования МАУ и ее перехода в протеинурию. В соответствии с механизмом формирования МАУ медикаментозные средства можно разделить на:- влияющие на процесс гиперфильтрации (ингибиторы ангиотензинпревращающего фермента (иАПФ), блокаторы рецепторов альдостерона, прямые ингибиторы ренина, симпатолитики и препараты с сопутствующим симпатолитическим действием (небиволол, эпросартан);блокаторы кальциевых каналов;
- влияющие на эндотелий (иАПФ, блокаторы рецепторов альдостерона, β-адреноблокаторы, блокаторы кальциевых каналов, статины).
Еще в 1988 году Marre М., а затем Early М. (1993) и Bianchi S. (1994) попытались провести сравнительный анализ эффективности различных антигипертензивных препаратов в отношении МАУ. Они показали, что ингибитор ангиотензинпревращающего фермента (иАПФ) эналаприл значительно эффективнее снижает уровень МАУ, чем антагонист кальция никардипин, b-адреноблокатор атенолол или просто диуретики в качестве средств монотерапии артериальной гипертензии.
В масштабных клинических исследованиях установлено, что ингибиторы АПФ обладают преимуществом перед другими антигипертензивными препаратами в плане воздействия на скорость развития нефропатии . По данным двойных слепых сравнительных исследований, иАПФ в большей степени влияли на экскрецию белка с мочой, чем другие антигипертензивные средства, хотя их антигипертензивный эффект был одинаковым [Моисеев В.С., 1996.], а следовательно, иАПФ оказывают ренопротективное действие у всех пациентов, независимо от антигипертензивного эффекта.
Механизм ренопротективного действия иАПФ отличен от простого антигипертензивного эффекта. Наиболее важным в действии иАПФ на сегодняшний день принято считать ослабление эффекта циркулирующего ангиотензина II на эфферентные артериолы. При уменьшении тонуса эфферентных артериол ослабевает, внутриклубочковое давление понижается, ослабевает или исчезает гиперфильтрация в клубочке и, как следствие, уменьшаются МАУ и протеинурия. Важно отметить, что применение иАПФ приводит к уменьшению синтеза в интерстиции факторов роста, эндотелина, что замедляет развитие нефросклероза. Rаvid M. (1993) и Shulman N.B. (1989) показали, что регулярный прием иАПФ приводит к достоверному уменьшению диаметра пор почечного фильтра у больных с нефропатией любого генеза.
Результаты исследования САРРР (Captopril Prevention Project, 1998) показали, что пациенты, лечившиеся ингибиторами АПФ, имели значительно меньший риск развития сердечно-сосудистых осложнений и смерти, чем пациенты, получавшие комбинированную терапию диуретиком и b-адреноблокатором. Это же исследование продемонстрировало, что сахарный диабет развивался значительно чаще у пациентов, получавших тиазидный диуретик и (или) b-адреноблокатор, по сравнению с больными, леченными иАПФ (в среднем на 21% за 6 лет наблюдения) [Сидоренко Б.А. и соавт., 2000.].
Однако на ранних этапах развития нефропатии (как диабетической, так и недиабетической) при нормоальбуминурии преимущество ингибиторов АПФ у больных с АГ не доказано. Их эффект близок таковому других антигипертензивных препаратов. Во всех остальных случаях ингибиторы АПФ являются лекарственными средствами первого ряда при планировании и проведении ренопротективной терапии.
После достижения целевого АД при гипертензии или в случае нормотензии последовательное титрование дозы иАПФ или блокаторов рецепторов альдостерона до максимально переносимой приводит к дальнейшему снижению микроальбуминурии (и протеинурии) [Иванов Д.Д., 2008].
На сегодня становится очевидным, что ИАПФ с преимущественно почечным путем выведения оказывают более выраженный (или в более короткие сроки) антигипертензивный и антипротеинурический эффект. Поэтому ИАПФ с внепочечным путем выведения (моэксиприл, моноприл, квадроприл), вероятно, имеют преимущества в первой стадии диабетической нефропатии, когда только формируются предпосылки появления МАУ. Эти препараты также незаменимы при сниженной функции почек (СКФ менее 60-30 мл/мин). Напротив, периндоприл, эналаприл, очевидно, более активны в приостановлении прогрессирования МАУ. В исследовании ADVANCE (2007) назначение нолипрела форте при сахарном диабете привело к достоверному снижению появления новых случаев МАУ (-31%), регрессу макроальбуминурии до МАУ и нормоальбуминурии (16%). В исследовании ONTARGET (2008) при прямом сравнении рамиприла с телмисартаном было получено снижение новых случаев диабета у пациентов, получающих иАПФ, на 12%.
Возможный алгоритм использования ИАПФ при диабетической болезни почек может быть представлен следующим образом (табл. 7.). Таблица 7. Алгоритм применения иАПФ при диабетической нефропатии
Целесообразным является сочетание иАПФ с тиазидоподобным диуретиком (индапамид, ксипамид). Отдать предпочтение какой-либо из групп препаратов (иАПФ, блокаторы рецепторов альдостерона) в настоящее время затруднительно. После опубликованных метаанализов, свидетельствующих о возрастании числа пациентов с ишемией на фоне использования блокаторов рецепторов альдостерона, их привлекательность в сравнении с иАПФ была подвергнута сомнению. Увеличение частоты ишемических событий на 9% при более выраженном снижении АД получено как при назначении блокаторов рецепторов альдостерона в сравнении с иАПФ, так и при сочетании этих групп препаратов, когда возрастают нежелательные эффекты, реализующиеся в снижении функции почек [исследование ONTARGET, 2008].
Результаты многочисленных исследований доказали явное преимущество спираприла перед другими антигипертензивными средствами в плане органопротективного воздействия и достоверного улучшения течения болезни у пациентов с почечной дисфунцией. В одном из исследований [Якусевич В.В. и соавт., 2000.] у больных мягкой и умеренной АГ в сочетании с сахарным диабетом и нарушенной функцией почек была показана высокая антигипертензивная эффективность спираприла в дозе 6 мг/сут и существенное улучшение функции почек: достигнуто достоверное уменьшение уровня креатинина крови и увеличение клиренса креатинина при отсутствии сдвигов уровней глюкозы и калия в крови. Также выявлено, что спираприл у больных артериальной гипертензией и сопутствующей диабетической нефропатией с хронической почечной недостаточность достоверно снижает фракционного клиренса альбумина (в среднем на 25,5%) и уменьшение 24-часовой МАУ (почти на 29,6%) .
Важнейший вопрос практической медицины - это определение того уровня АД, ниже которого рост протеинурии прекращается и начинается снижение уровня МАУ. По данным, приведенным в исследовании Microalbuminuria Captoprili Study Group (1996), такой уровень соответствует 125/75 мм рт.ст. В то же время, по данным Barnas D. (1998), это достигается при ДАД меньше 90 мм рт.ст. В 1998 г. были опубликованы результаты исследования HOT (Hypertension Optimal Treatment), в котором безопасный уровень АД расчетно определен как 138/83 мм рт.ст. Таким образом, ДАД меньше 90 мм рт.ст. следует считать целью при лечении больных СД и АГ.
Однако по мере возрастания тяжести исходного состояния пациентов наблюдается «ускользание» простого эффекта снижения АД и нормализации почечной гемодинамики. Установлено, что при низком уровне МАУ эффективны все препараты, нормализующие АД и почечную гемодинамику. По-видимому, на данном этапе степень деструкции почечного фильтра такова, что простой нормализации внутриклубочкового давления достаточно для нивелирования потери белка. Однако при более высоком уровне потери белка успех достигается только при применении и АПФ и блокаторов рецепторов ангиотензина II. Нарастающий нефропротективный эффект данных препаратов прослеживается и после нормализации АД.
ЗАКЛЮЧЕНИЕ
Ошибочно говорить о МАУ в качественном аспекте – «обнаружена» или «не обнаружена». Уровень МАУ имеет большое значение: чем он выше, тем тяжелее исходное состояние больного. Следовательно, оправдана градация МАУ по уровню выраженности, поскольку очевидна различная тактика выбора медикаментозного лечения для пациентов с различными исходными уровнями МАУ.Для диагностики хронической болезни почек у взрослых пациентов с сердечно-сосудистыми заболеваниями или повышенным риском их развития необходимо определить скорость клубочковой фильтрации и отношение альбумин/креатинин в моче (табл. 8). Для пациентов с установленной ИБС, хронической сердечной недостаточностью, факторами риска (артериальная гипертензия, сахарный диабет) целесообразна обязательная оценка обоих показателей. При выявлении патологического значения хотя бы одного из показателей, необходимо повторить исследование через 3 мес. Хроническая болезнь почек диагностируется при подтверждении патологического значения хотя бы одного из этих показателей.
Таблица 8. Рекомендации и уровень доказанности по выявлению нарушения функции почек у взрослых пациентов с ССЗ или повышенным риском их развития [Комитет экспертов Всероссийского научного общества кардиологов и Научное общество нефрологов России (2008)]
Примечание: формула MDRD для расчета скорости клубочковой фильтрации СКФ (мл /мин/) = 186×(креатинин крови, мг/дл)-1,154×(возраст, лет)-0,203 для женщин результат умножают на 0,742, для лиц негроидной расы результат умножают на 1,210
В дальнейшем тактика врача определяется следующим алгоритмом:
- Определить уровень креатинина сыворотки и рассчитать скорость клубочковой фильтрации пo формуле MDRD. Если расчетная СКФ
www.med-m.su
Микроальбумин в моче
Анализ на микроальбумин в моче выписывается лечащим врачом для диагностики мочевыводящих путей и для профилактического наблюдения за состоянием здоровья пациента. Если альбумин в моче повышен, то это может быть показателем начала диабетической нефропатии и сердечно-сосудистых заболеваний.

Что это такое?
Микроальбумины - маленькие по размеру альбумины, белки организма, что растворяются в воде. В норме почки выводят некоторое количество микроальбуминов, но часть они задерживают из-за размера (69 кДа). При нарушении работы почечных клубочков в урину пропускается лишнее количество альбуминов. Анализ мочи на микроальбуминурию назначается при подозрении начальных стадий нефропатии и аутоиммунных заболеваний. На самом деле направление на анализ на микроальбумин - единственный способ преждевременно определить первичную стадию нефропатии. В редких случаях присутствие небольшого количества микроальбумина в моче вскоре переходит в тяжелые случаи протеинурии.
Микроальбуминурия - что это такое? На поздних стадиях патология носит достаточно серьезный характер, поражая многочисленные органы и системы. Выявление сбоя в организме предполагает определение уровня белка альбумина в составе мочи. Вещество выступает одним из компонентов крови, а его содержание в продуктах жизнедеятельности может указывать на развитие сложных заболеваний.
Что представляет собой микроальбуминурия?
Анализ на микроальбуминурию дает возможность выявить заболевания мочевыводящих путей на ранних стадиях. Насыщение телесных жидкостей обилием белка наблюдается в случаях, когда имеет место повреждение почечных клубочков. Выделение альбумина выступает важнейшим сигналом, который может свидетельствовать о наличии
Помимо прочего, клинический (расшифровка осуществляется специалистом) дает возможность определить сбои в работе органов сердечно-сосудистой сферы. Чаще всего в данных целях к исследованию прибегают люди пожилого возраста.
Согласно понятию о норме, белок альбумин должен насыщать мочу в незначительных количествах. Обусловлено это особым строением почечных тканей, которые отфильтровывают вещество и не пропускают его молекулы.
Нормативные показатели

Содержание альбумина в моче взрослого человека не должно превышать 30 мг в сутки. Наряду с этим, белок практически не содержится в продуктах жизнедеятельности здоровых детей. Превышение нормы свидетельствует о развитии нефропатии. Если выработка альбумина достигает 300 мг в сутки и более, это говорит о патологическом поражении почек.
Микроальбуминурия при сахарном диабете, помимо повышения процентного соотношения приводит к насыщению телесной жидкости сахарами. Чтобы подтвердить неутешительный диагноз, врачи проводят повторную диагностику через 6-11 недель после первого исследования.
Что показывает повышение альбумина в моче?
Если процентное содержание вещества в отклоняется от нормы, это может свидетельствовать о развитии следующих заболеваний:
- сахарный диабет;
- сбои в работе органов сердечно-сосудистой системы;
- артериальная гипертония;
- индивидуальная непереносимость фруктозы;
- саркоидоз.
Если говорить о наиболее распространенной причине микроальбуминурии, стоит отметить именно сахарный диабет. Проявляется повышенное насыщение мочи белком альбумином спустя несколько лет после развития заболевания. Поэтому тест на концентрацию вещества в телесной жидкости позволяет с высокой точностью определить превышение нормы глюкозы.
Клинические проявления

Повышение альбумина в моче проходит в несколько стадий:
- Бессимптомная - от больного не поступает жалоб, однако в организме наблюдаются характерные изменения.
- Начальная - патологических нарушений в организме все еще не выявлено. В то же время развивается снижение эффективности клубочковой фильтрации в почечной ткани.
- Преднефротическая - суточная моча насыщается обилием белка. Больной страдает от повышения давления ввиду повышенной активизации работы почек.
- Нефротическая - человек наблюдает появление отечностей на теле. В моче помимо значительного количества альбумина наблюдается появление эритроцитов. Повышается уровень выработки организмом мочевины и креатинина.
- Стадия уремии (почечная недостаточность) - сопровождается частыми и резкими скачками артериального давления. Отечные области на теле приобретают устойчивый характер. В значительной степени повышается уровень эритроцитов в мочевине. Скорость отработки токсичных веществ почечной тканью существенно падает. Суточная моча насыщается глюкозой. В то же время замедляется выведение из организма инсулина.
Физиологические проявления микроальбуминурии

Микроальбуминурия (в моче много белка альбумина) может проявляться следующими симптомами: боли в груди, наличие устойчивого дискомфорта в левой части туловища, повышение давления и общее ухудшение самочувствия.
Одним из последствий развития патологии на поздних стадиях становятся признаки инсульта. В данном случае люди, подверженные заболеванию, нередко страдают от периодической потери сознания, затруднения речи, слабости в конечностях. Указанные проявления могут дополняться головокружением, частыми головными болями.
Как сдавать мочу?

Для определения уровня белков-альбуминов в продуктах жизнедеятельности требуется сдача образца мочи. Назначить проведение исследования может уролог, эндокринолог, гинеколог либо терапевт.
Клинический? Расшифровка результатов покажет наиболее достоверную картину, если пациент все сделает правильно. Для исследований, направленных на определение содержания соли в телесной жидкости и сбоев в функционировании почек, используют биоматериал, собранный за сутки до теста. Чтобы получить достоверные результаты анализа, рекомендуется применять специальный контейнер для мочи. Процедура осуществляется следующим образом:
- порядка 200 мл мочи отливают в контейнер;
- емкость сдают в лабораторию;
- при необходимости выполняют повторный анализ;
- результаты рассчитываются нефрологом исходя из веса пациента.
Как сдавать мочу при подозрениях на сахарный диабет? организма, выделяемые в течение суток, сливаются в объемную емкость, после чего помещаются на хранение в холодильник. Утренняя порция мочи в количестве 200 мл, собранная на следующий день, перемешивается с ранее полученным объемом. В контейнер для мочи выливается порядка 150 мл из общего количества. Емкость направляется в лабораторию с указанием возраста пациента, общего объема полученной за сутки жидкости.
Терапия

Микроальбуминурия - что это такое и как устранить ее проявления? Лечение предполагает применение комплексного подхода. Людям, что страдают от повышения уровня сахара в крови, предписывают препараты, понижающие давление и устраняющие скопление холестерина. В случае недостаточного количества глюкозы в организме назначают курс инъекций инсулина.
Независимо от причины возникновения патологического проявления, в целях снижения процентного содержания белка альбумина в крови больным рекомендуют прибегать к следующим мероприятиям:
- регулярно измерять уровень глюкозы в крови;
- следить за давлением;
- контролировать холестерин;
- избегать развития инфекционных заболеваний;
- придерживаться диеты на основе низкокалорийной, нежирной пищи;
- отказываться от курения и употребления спиртного;
- потреблять порядка полутора литров воды в течение суток.
Людям с микроальбуминурией приходится довольно часто прибегать к госпитализации. Без проведения адекватной диагностики и применения соответствующих методов терапии существует высокий риск летального исхода ввиду развития проблем сердечного характера. Поэтому при обнаружении первых симптомов патологии - наличии проблем с давлением, повышением уровня сахара в крови - необходимо немедленно обратиться в стационар для сдачи анализов.
Группа риска

Микроальбуминурия - что это такое? Риск развития патологии возникает у людей, которые потребляют обилие белковой пищи. Возникнуть заболевание может и в ответ на изнурительные ежедневные физические нагрузки.
В целом же прибегать к исследованиям на микроальбуминурию рекомендуется:
- Больным, которые страдают сахарным диабетом в начальной стадии. Таким людям следует сдавать анализ мочи не реже одного раза в год.
- Пациентам с сахарным диабетом второй стадии нужно проводить исследования на определение уровня белка альбумина в моче несколько раз в год.
- Людям с ишемической болезнью сердца, нарушением чувствительности к сахарам, пациентам, что унаследовали генетическую форму дислипидемии.
Где можно провести тест на микроальбуминарию?

Сдать мочу на анализ можно, обратившись за помощью в любую городскую поликлинику, на базе которой функционирует исследовательская лаборатория. Для обследования также подходят диагностические кабинеты стационаров.
При желании можно записаться на прием в частную клинику. Однако такое решение в большинстве случав выглядит нецелесообразным: выявление повышенной нормы белка в моче выступает довольно простым тестом, а используемые государственными медицинскими учреждениями методы точны и надежны, так что нет нужды переплачивать.
В заключение
Микроальбуминурия - что это такое? Патологическая концентрация белка альбумина в составе урины, что приводит к риску развития сердечных заболеваний, возникновению нарушений в работе почек. Без должного лечения все это может перерасти в поражение мозговой ткани.
Определение уровня альбумина в моче выступает не только основой для постановки правильного диагноза, но и позволяет оценивать эффективность используемых методов терапии. При своевременном обнаружении повышения показателя, а также приеме нефропротекторных медикаментов можно избежать развития серьезных осложнений.
Микроальбуминурия – это серьезное отклонение, которое на поздних этапах прогрессирования представляет смертельную угрозу для человека. Подобное нарушение можно определить только при лабораторном исследовании мочи на альбумин. Это вещество присутствует в крови человека, поэтому его появление в биологической жидкости ничего хорошего не сулит.
Что это такое микроальбуминурия, чем она может быть опасна для здоровья пациента, и как собрать урину для исследования на предмет присутствия в ней альбумина? Давайте разберемся по порядку.
Что такое МАУ?
МАУ или микроальбуминурия - это наличие альбумина в биологической жидкости. Свидетельствует оно о наличии различных (чаще всего – почечных) патологий, и может протекать в 5 степенях тяжести.
- На первой стадии микроальбумин в моче практически не обнаруживается. Протекает она абсолютно бессимптомно, поскольку болезнь только начинает развиваться.
- Начальная фаза развития. У пациента продолжают происходить опасные патологические изменения, однако уровень альбумина в биологической жидкости не превышает нормативные показатели.
- Третья фаза – преднефротическая. На данном этапе болезнь уже модно обнаружить с помощью выполнения анализа мочи на МАУ. При необходимости назначаются и другие диагностические процедуры, направленные на оценку функций почечных фильтрационных клубочков.
- Фаза нефроза. Пациент страдает от артериальной гипертензии и отечности конечностей и лица. В клиническом анализе четко видны , эритроцитурии, появление креатинина и мочевины.
- Развитие почечной недостаточности. Пациент страдает от частых приступов артериальной гипертензии, у него практически не проходят отеки, в анализе урины присутствует белок, кровяные тельца, частицы мочевины и креатинина. Сахар отсутствует.
Все эти стадии микроальбуминурии проходит пациент при сахарном диабете. Если своевременно не отреагировать на опасные симптомы, то, помимо диабетического нефроза, больной рискует впасть в диабетическую кому, а это уже несет прямую угрозу его жизни.
Оптимальные показатели и серьезные отклонения
Альбумин в моче может быть обнаружен у нескольких категорий пациентов, а именно:
- диабетиков;
- людей, страдающих от почечных патологий;
- пациентов с атеросклеротической болезнью сердца;
- сердечников.
Норма микроальбумина в моче человека зависит от множества факторов. Если хотя бы один из них имел место, уровень вещества может резко повыситься. Этими факторами являются:
- чрезмерная физическая активность;
- злоупотребление белковой пищей;
- дефицит жидкости в организме, обезвоживание;
- лихорадка;
- воспалительные процессы, протекающие в органах мочевыделительной системы;
- табакокурение;
- гипертрофические процессы в области миокарда;
- почечное воспаление;
- резкое .
Суточная норма МАУ в моче любого человека, независимо от его возраста, не должна превышать 30 мг. Если эти показатели были превышены, пусть даже и немного, это должно стать основанием для более тщательного обследования пациента. Так, нередко подобные отклонения свидетельствуют о развитии нефропатии, которая может перерасти в более серьезную проблему.
Если норма альбумина в моче была превышена в 10 раз, и на данный момент суточная доза составляет 300 мг, это говорит о патологическом и весьма опасном для жизни поражении почек.
Что показывает анализ урины на МАУ и когда необходим?
Для начала необходимо разобраться, что это за анализ мочи на МАУ. Выполняется такое клиническое исследование только при наличии определенных показаний, которые мы рассмотрим немного позже. С помощью такой пробы лаборант вычисляет количество альбумина, а также обнаруживает (или не обнаруживает) вещества, которых у здоровых людей не наблюдается – протеин, сахар, эритроциты и др.
Анализ МАУ помогает определить наличие:
- сахарного диабета;
- саркоидоза;
- серьезные нарушения сердечно-сосудистой системы;
- артериальной гипертензии;
- аллергии на фруктозу.
Однако самой распространенной причиной того, что микроальбумин в моче повышен, является именно сахарный диабет. Анализ на обнаружение этого вещества в урине необходим, если пациент:
- жалуется на частую или постоянную боль в области грудной клетки;
- ощущает сильный дискомфорт в левой части грудной клетки, или даже всего туловища;
- страдает от частых приступов гипертонии;
- ощущает общую слабость, вялость, усталость.
На поздних стадиях у пациента могут проявиться явные симптомы инсульта. Последствия заболевания могут быть очень опасными, поэтому с частыми головокружениями, синкопе, приступами тошноты и другими признаками необходимо обязательно обратиться к врачу.
Как правильно подойти к сбору урины для анализа?
Анализ мочи на микроальбуминурию может быть назначен эндокринологом, терапевтом, урологом или кардиологом. У детей на такое исследование может направить семейный врач или педиатр. Если у пациента было обнаружено присутствие альбумина в урине, то прежде чем предпринимать какие-либо действия, его необходимо дообследовать. Дополнительные диагностические процедуры помогут установить причину недомоганий, и только потом начать ее устранение.
Как сдавать анализ мочи на микроальбуминурию? Это важно знать для того, чтобы получить правдивые результаты клинического исследования биологической жидкости. Сбор урины зависит от того, с какой целью он проводится.
Так, моча на МАУ для определения наличия солей собирается за 24 часа до проведения пробы. Чтобы не допустить попадания в образец различных веществ или частиц, приобретите специальный пластиковый контейнер для сбора урины. Далее сделайте следующим образом:
- отлейте 200-250 мл собранной урины в контейнер;
- отдайте тару на исследование;
- дождитесь результатов, а при необходимости проведите повторный сбор биологической жидкости.
Как собирать анализ мочи на МАУ при подозрении на развитие сахарного диабета? Собрать необходимо суточную урину, после чего ее следует поставить в холодное место. На следующий день отлить 100 мл жидкости в пластиковый контейнер, смешав ее со свежей уриной. Накрыть емкость крышкой, стараясь, чтобы она герметично закрывала тару.
Отправляя контейнер с биологической жидкость на анализ, обязательно укажите необходимые данные: возраст, вес, дату сбора урины. При необходимости вы можете указать специалиста, который будет расшифровывать результаты, а также дату своего рождения.
Что касается того, каким должно быть соотношение альбумина к креатинину в моче, то суточная норма должна быть таковой:
- альбумин – менее 30 мг;
- креатинин – не более 3 мг.
Превышение этих норм указывает на серьезные сбои в работе организма. Если подобные аномалии продолжаются на протяжении 3 месяцев и больше, то нередко они свидетельствуют о хронических почечных заболеваниях.
В довершение всего вышесказанного необходимо отметить, что предотвратить серьезную патологию можно только при условии регулярного прохождения профилактических клинических исследований урины. При других обстоятельствах исправить ситуацию может быть невозможно.
Врач назначает не только для определения количества содержания в ней глюкозы, но и для контроля работы почек.
Расшифровка данных содержит сведения об основных показателях урины: цвете, запахе, прозрачности и концентрации различных веществ.
При наличии отклонений в данных врач назначает дополнительное обследование и соответствующее заболеванию лечение. Содержание сахара в моче по результатам суточного теста или экспресс-метода должно быть минимальным, а в норме – отсутствовать вовсе.
Показания к сдаче урины
Чаще всего анализ на сахар назначает врач при подозрении на нарушения в работе эндокринной системы. Обследование рекомендуют проходить потенциально здоровым пациентам раз в три года. Изменение уровня глюкозы может предупредить о развитии серьезного заболевания на ранней стадии.
Регулярно анализ назначают с целью:
- диагностирования ;
- оценки эффективности лечения;
- коррекции гормональной терапии;
- определения количества глюкозы, теряемой с мочой.
Подготовка к исследованию
Чтобы результаты исследования были достоверными, следует соблюдать определенные правила подготовки к нему:

- накануне анализа из рациона питания исключают острые, соленые блюда. Количество потребляемых нужно свести к минимуму. Придерживаться такого меню желательно дня за два до анализа;
- пациент не должен перегружать себя физическим трудом и . Также следует избегать ;
- накануне нежелательно прохождение медицинских исследований, которые доставляют психологический и физиологический дискомфорт;
- сбор урины на суточный анализ производят в течение 24 часов. Это необходимо для оценки изменений, происходящих с уриной за этот период. Утреннюю порцию в этом случае не берут, поскольку она содержит наибольшее количество глюкозы.
Забор начинают производить со второй порции мочи. Вся жидкость, собранная за сутки, сливается в общую тару, помещенную в холодильник.
Для удобства можно использовать стеклянную банку. Через 24 часа содержимое емкости перемешивают, сливают 100 мл урины в чистую тару и относят на анализ.
Расшифровка показателей анализа мочи на сахар
В норме здоровый человек выделяет около 1500 мл мочи.Любые отклонения от показателей говорят о развитии той или иной патологии.
Если мочи выделяется слишком много, у пациента наблюдается , характерная для сахарного диабета. Цвет нормальной мочи варьируется от соломенного до желтого. Слишком яркая окраска сигнализирует о недостаточном потреблении воды, задержке жидкости в тканях.
Мутный осадок – признак развивающейся мочекаменной болезни, наличия в ней фосфатов, гнойных выделений. Запах урины здорового человека не резкий, без специфических примесей. Белка не должно быть более 0.002 г/л. Показатель водорода в норме – (рН)-5-7.
Если в урине обнаружена глюкоза, пациенту назначают .
Норма при сахарном диабете
В моче человека сахар должен отсутствовать. Предельно допустимая концентрация вещества – 0, 02 %.
Причины отклонения результатов от норматива
 Глюкоза содержится в урине у пациентов с:
Глюкоза содержится в урине у пациентов с:
- диабетом;
- проблемами с поджелудочной железой;
- синдромом Кушинга.
У многих беременных при сдаче анализа мочи обнаруживается сахар, а также у тех, кто злоупотребляет и продуктами с его содержанием.
Определение уровня глюкозы в моче при помощи тест-полосок
Индикаторные разового применения позволяют оценить качественный и полуколичественный состав урины.Действие их основано на ферментативной реакции глюкозооксидазы и пероксидазы.
В результате процесса меняется цвет индикаторной зоны. Применять их можно дома и в стационарных учреждениях.
Тест-полоски используют больные с нарушениями метаболизма жирных кислот, пациенты с сахарным диабетом для удобства контроля уровня глюкозы.
Видео по теме
Что такое анализ мочи МАУ? Какова норма при сахарном диабете? Ответы в видео:
Для определения количества содержащейся в организме глюкозы врач назначает анализ мочи: общий или суточный. Второй позволяет более подробно оценить состояние почек, выявить причины превышения нормальных показателей.
У человека в моче не должна присутствовать глюкоза. Для достоверности результатов анализов следует накануне исследования избегать употребления в пищу , томатов, цитрусовых, а также не усердствовать с физической нагрузкой.
Перед сдачей материала необходимо провести гигиенические процедуры, чтобы в него не попали бактерии. Основными показаниями к исследованию являются эндокринные заболевания, сахарный диабет.
Если при обследовании обнаружен микроальбумин в моче, у пациентов сразу возникает целый ряд вопросов: что это такое, какое значение этот показатель имеет для организма? Какая вообще должна быть норма альбуминов в моче? И при каком заболевании возникают такие изменения в анализах?
Чтобы получить ответ на эти и другие вопросы, надо разобраться, как работает фильтрационная система почек.
К альбуминам относятся белки, обладающие свойством растворяться в воде и образующиеся в процессе метаболизма. Здоровые почки не пропускают белки через свой мембранный аппарат. Образно говоря, белковые соединения значительно больше по размеру, чем просвет почечного фильтра. Поэтому при исследовании в моче не должно быть никаких белковых фракций. По физиологическим причинам в анализе иногда могут обнаруживаться только следы белка.
При развитии патологических процессов в почках происходят изменения в тканях почек, в том числе и в фильтре. При этом структура клеток фильтра меняется настолько, что в нем появляются достаточно большие бреши, через которые становится возможным проникновение в мочу крупных белковых молекул.
Если исследованию подвергается суточная моча, то норма содержания альбуминов в анализе составляет до 30 мг. Превышение этого показателя до 300 мг называется уже микроальбуминурия (МАУ). Анализ утренней порции мочи на микроальбумин в этом случае показывает содержание белка в моче 20 – 200 мг в мл.
МАУ всегда является сигналом скорого развития протеинурии, при которой содержание альбуминов в моче превышает 200 мг/мл в утренней порции и 300 мг в суточной.
Протеинурия является показателем глубоких необратимых патологических процессов в почечных тканях.
Чтобы получить достоверный результат исследования урины, надо выполнить все правила по ее сбору:
- Как правильно собрать суточную мочу для анализа?
 Собирать мочу надо с утра сразу после пробуждения. Первая утренняя порция сливается. При этом надо записать точное время посещения туалета. Затем в течение 24 часов моча каждый раз собирается в большую чистую емкость (можно использовать трехлитровую банку). По истечении суток собранную мочу можно отнести в лабораторию для обследования. Но лучше приобрести в аптеке специальный контейнер для анализа и отлить в него урину в количестве не менее 50 мл, предварительно перемешав ее. При этом надо обязательно записать объем мочи, собранной за сутки, и указать эти цифры лаборанту.
Собирать мочу надо с утра сразу после пробуждения. Первая утренняя порция сливается. При этом надо записать точное время посещения туалета. Затем в течение 24 часов моча каждый раз собирается в большую чистую емкость (можно использовать трехлитровую банку). По истечении суток собранную мочу можно отнести в лабораторию для обследования. Но лучше приобрести в аптеке специальный контейнер для анализа и отлить в него урину в количестве не менее 50 мл, предварительно перемешав ее. При этом надо обязательно записать объем мочи, собранной за сутки, и указать эти цифры лаборанту.
- Как сдавать мочу для общего анализа?
В этом случае мочу также лучше собирать с утра. Перед забором урины надо обязательно сделать туалет области промежности. Женщинам лучше воспользоваться ватным тампоном, чтобы в анализ не попали выделения из влагалища. Для анализа берется средняя порция. Для этого надо начать испускать мочу в унитаз и, только после этого подставить под струю контейнер. Закончить процесс мочеиспускания надо также в унитаз.
Правильный забор мочи для анализа поможет поставить точный диагноз и своевременно начать специфическое лечение.
Что означают результаты
Анализ мочи на микроальбуминурию используется для диагностики целого ряда заболеваний, а также для контроля состояния организма больного при некоторых патологиях.
Исследование урины проводится при:- сахарном диабете I и II типа. Эта группа пациентов сдает анализ мочи на МАУ каждые полгода;
- заболеваниях сердечно-сосудистой системы, в частности, явлениях сердечной недостаточности, а также при стойком декомпенсированном повышении артериального давления;
- в период беременности при подозрении на развитие нефропатии. Также если в этот период в моче повышен белок, можно предположить развитие эклампсии;
- различных системных заболеваниях, сопровождающихся специфическим поражением почечной ткани;
- дифференциальной диагностике патологии почек.
Если норма содержания белка в моче превышена, больному ставится микроальбуминурия. Следует иметь в виду, что это не диагноз, а симптом, определяющий поражение почек при целом ряде различных заболеваний.
Расшифровка анализа мочи должна проводиться только врачом. С целью обнаружения причины появления белка в моче доктор может назначить дополнительные обследования и консультации нефролога, уролога, гинеколога, эндокринолога, кардиолога и других специалистов.

Микроальбуминурия может появляться в анализе урины на фоне полного здоровья. Физиологические причины появления белка в моче могут быть самыми разными. Но при отсутствии патологии в организме появление небольшого количества альбуминов – это норма при перечисленных ниже состояниях.
Высокое содержание белка в анализе мочи провоцируется:- состоянием сильного обезвоживания организма;
- после изнурительных физических нагрузок;
- у беременных;
- большое количество белка в продуктах питания, а также употребление белковых пищевых добавок. Этой белковой диетой наиболее часто пользуются спортсмены.
- переизбыток жидкости в тканях организма, проявляющийся отеками;
- употребление в пищу недостаточного количества белка, вегетарианство;
- прием лекарственных средств, содержащих фермент, участвующий в метаболизме ангиотензина, и понижающих, таким образом, артериальное давление;
- терапия нестероидными противовоспалительными средствами.
При сдаче общего анализа мочи надо обязательно учесть влияние факторов, влияющих на содержание белков в моче.
Чтобы получить достоверный результат, перед тем, как собирать урину, надо проконсультироваться с лечащим врачом по поводу диеты и используемых лекарственных препаратов.